Artemis : du désordre à la réparation de l'ADN
Toutes les protéines ne sont pas repliées selon une conformation(*) unique car elles sont flexibles et peuvent donc présenter plusieurs formes stables. Grâce à cette flexibilité, certaines parties de ces protéines dites désordonnées peuvent adapter leur géométrie pour optimiser leurs interactions avec d’autres biomolécules au sein des cellules et donc leurs fonctions.
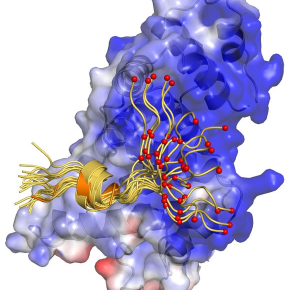
C’est le cas de la protéine Artemis impliquée dans la réparation des cassures double-brins de l’ADN. Près de la moitié d’Artemis est intrinsèquement désordonnée, partie qui intéresse tout particulièrement les chercheurs car les interactions de ces régions désordonnées avec d’autres protéines ont un rôle dans le processus de réparation. Hélas, les méthodes de caractérisations structurales « classiques » comme la cristallographie par diffraction des rayons X ne permettent d’avoir accès qu’aux conformations des régions ordonnées de la protéine, pas aux parties désordonnées.
Une équipe du Laboratoire des biomolécules (CNRS/ENS/Sorbonne Universités) a mis au point une méthode simple pour caractériser les régions ordonnées et désordonnées de cette protéine lorsqu’elles interagissent avec d’autres protéines. Cette méthode s’inspire des techniques récemment développées en RMN pour étudier des systèmes en échange, c’est-à-dire qui peuvent explorer, à l’équilibre, plusieurs environnements différents. Les chercheurs ont pu ainsi accéder aux conformations d’une région partiellement ordonnée de la protéine Artemis lorsqu’elle interagit avec la Ligase IV, l’enzyme achevant la réparation de l’ADN par « ligation » des brins. D’autres systèmes moléculaires de grande taille devraient ainsi pouvoir être caractérisés par cette nouvelle approche qui enrichit la boite à outils de la biologie structurale.
Ces travaux sont parus dans le Journal of the American Chemical Society.
(*) Disposition tridimensionnelle d’atomes ou de fragments moléculaires liés entre eux par des liaisons chimiques.
![]()
Référence
Cyril Charlier, Guillaume Bouvignies, Philippe Pelupessy, Astrid Walrant, Rodrigue Marquant, Mikhail Kozlov, Pablo De Ioannes, Nicolas Bolik-Coulon, Sandrine Sagan, Patricia Cortes, Aneel K. Aggarwal, Ludovic Carlier & Fabien Ferrage
Structure and dynamics of an intrinsically disordered protein region that partially folds upon binding by chemical-exchange NMR
Journal of the American Chemical Society 7 août 2017