Le ribosome étend sa production aux molécules en hélice
Des chercheurs de l’Institut de chimie et biologie des membranes et nano-objets (CNRS/Université de Bordeaux/IPB, équipe IECB) et de l’Université de Tokyo ont montré que le ribosome, cette machine moléculaire qui produit les protéines au sein des cellules, permet également la production de protéines hybrides à partir de molécules aromatiques non naturelles. Une production utile pour découvrir des substances actives, par exemple des agents thérapeutiques. Ces résultats sont parus dans Nature Chemistry.
Le ribosome est une machine moléculaire essentielle, chargée de produire les protéines de toutes les cellules du vivant en assemblant en séquences ordonnées des briques de base. Dans la nature, ces briques de base sont les vingt acides aminés naturels. Mais des chercheurs de l’Institut de chimie et biologie des membranes et nano-objets (CNRS/Université de Bordeaux/IPB, équipe IECB) et de l’Université de Tokyo ont découvert que la capacité du ribosome à intégrer des entités non naturelles est bien plus grande qu’on ne l’imaginait.
La synthèse protéique se fait par traduction de l’information génétique contenue dans les acides nucléiques, chaque acide aminé successif traduisant des éléments précis d’information génétique. Au cours de ces dernières années, il a été montré que la traduction peut être manipulée in vitro par le biais d’une sorte de reprogrammation du code génétique. Le ribosome permet notamment la production de protéines artificielles aux propriétés modulables, à partir d’analogues non naturels des vingt acides aminés.
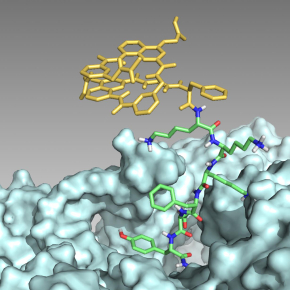
Les chercheurs ont montré que cette possibilité s’étend à des molécules aromatiques non naturelles ayant une propension à se replier en hélice : des foldamères. De telles molécules ont ainsi pu être intégrées pendant l’étape d’initiation de la synthèse de peptides par le ribosome. Des hybrides foldamère-peptide ont ainsi été produits sous forme linéaire ou cyclique, chacun comportant un motif foldamère replié en hélice qui peut servir à contrôler la conformation du peptide.
L’extension de la gamme des substances que le ribosome peut produire est un moyen efficace pour découvrir des substances actives, par exemple des agents thérapeutiques, par les méthodes dites d’évolution dirigée. Il est ainsi attendu que des hybrides foldamère-peptides puissent accomplir des tâches difficiles pour un peptide seul, comme celle de pénétrer dans les cellules ou de résister à la digestion par des enzymes. De grands enjeux, notamment pour les médicaments.
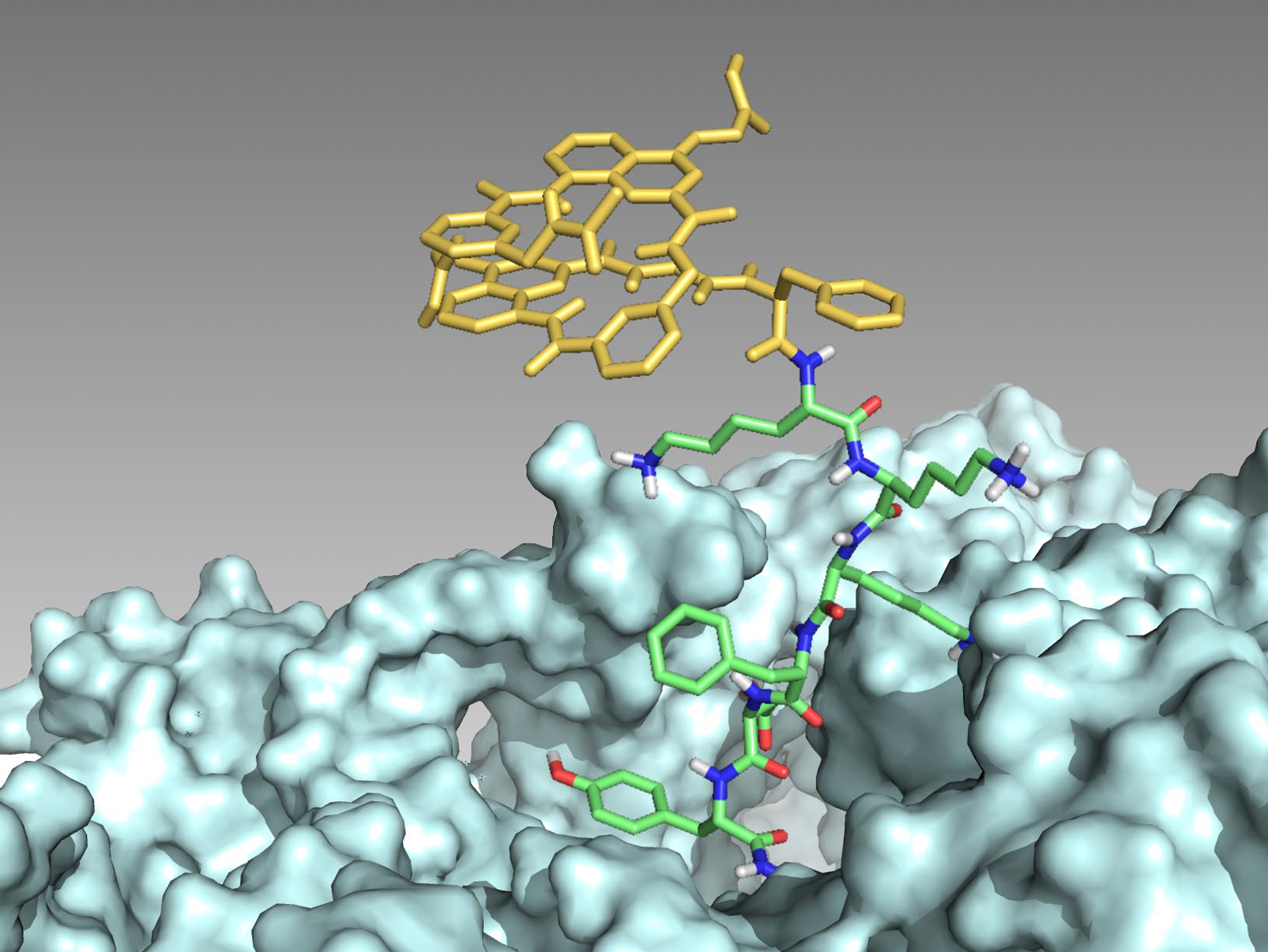
©Sunbum Kwon
Références
Joseph M. Rogers, Sunbum Kwon, Simon J. Dawson, Pradeep K. Mandal, Hiroaki Suga, Ivan Huc
Ribosomal synthesis and folding of peptide-helical aromatic foldamer hybrids
Nature Chemistry - Mars 2018
DOI: 10.1038/s41557-018-0007-x
Fitting foldamers through the ribosome
Couverture Nature Volume 10 Issue 4, April 2018