Cancer : un nouveau mécanisme de régulation de l’activité cellulaire impliquant le fer
Des chercheurs et chercheuses du CNRS à l’Institut Curie viennent de mettre en évidence que les cellules cancéreuses utilisent une protéine membranaire, décrite depuis plusieurs décennies, pour internaliser du fer. Publiés dans Nature Chemistry le 3 août 2020, ces travaux montrent que le fer ainsi absorbé permet aux cellules cancéreuses d’acquérir les propriétés de cellules métastatiques.
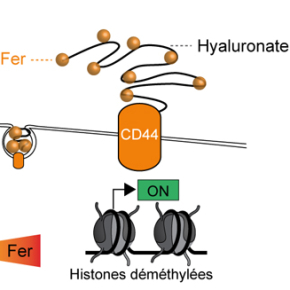
Les biologistes la connaissent bien, mais ils ignoraient encore la fonction biologique majeure qu’elle remplit. CD44 est une glycoprotéine que l’on retrouve à la surface de nombreuses cellules, dans différents organes, qui est en plus impliquée dans plusieurs processus biologiques : réponse immunitaire, inflammation, cancer… Pour la première fois, une équipe de recherche vient de montrer qu’elle participait à ces phénomènes en permettant l’entrée du fer dans les cellules par endocytose.
Les scientifiques du laboratoire Chimie et biologie de la cellule (CNRS/Inserm/Institut Curie) et leurs collègues1 sont arrivés à cette conclusion en étudiant l’activité de CD44 dans des cellules cancéreuses, et les modifications du métabolisme et de l’expression génétique qui en découlent.
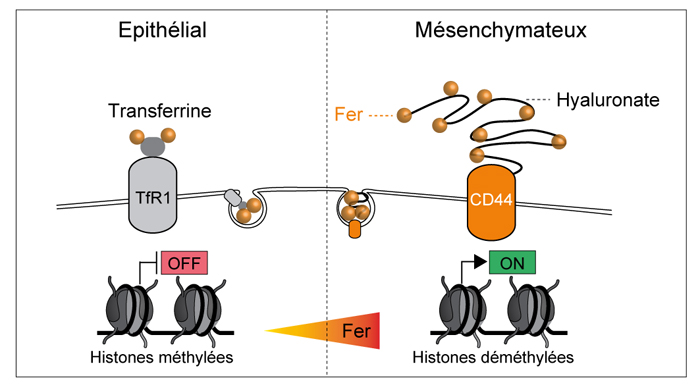
Leurs résultats montrent que CD44 permet l’internalisation de fer fixé à l’acide hyaluronique. Pour les cellules cancéreuses, le fer remplit alors deux rôles : il approvisionne les mitochondries pour qu’elles produisent des métabolites nécessaires au passage de la cellule à un état métastatique et « déverrouille » au niveau épigénétique certains gènes également nécessaires au processus métastatique. Dans cet état, CD44 devient même la principale porte d’entrée du fer dans les cellules.
Ces observations expliquent pourquoi CD44 était déjà connue pour son association avec l’apparition de métastases et de récidives. Mais elles sont aussi surprenantes car les biologistes pensaient jusqu’ici qu’un seul autre mécanisme entrait en jeu dans l’endocytose du fer, impliquant la transferrine et son récepteur TfR1. L’équipe de recherche espère maintenant mettre au point des molécules capables de bloquer le trafic cellulaire de fer afin d’éliminer les cellules à fort potentiel métastatique.
Ces recherches ont bénéficié d’une subvention ERC Consolidator, d’une labellisation de la Ligue contre le cancer et de la Fondation Charles Defforey - Institut de France.
© Raphaël Rodriguez
- 1Ont également participé à ces travaux des chercheurs et chercheuses du Centre de recherche en cancérologie de Marseille (CNRS/Inserm/Institut Paoli Calmettes/Aix-Marseille Université), du laboratoire Dynamique de l'information génétique : bases fondamentales et cancer (CNRS/Sorbonne Université/Institut Curie), du laboratoire Cancer et génome : Bioinformatique, biostatistiques et épidémiologie des systèmes complexes (Inserm/Mines Paristech/Institut Curie), de la plateforme de séquençage haut débit ICGex (Institut Curie) et du Laboratoire de spectrométrie de masse et protéomique (Institut Curie).
CD44 regulates epigenetic plasticity by mediating iron endocytosis, Sebastian Müller, Fabien Sindikubwabo, Tatiana Cañeque, Anne Lafon, Antoine Versini, Bérangère Lombard, Damarys Loew, Ting-Di Wu, Christophe Ginestier, Emmanuelle Charafe-Jauffret, Adeline Durand, Céline Vallot, Sylvain Baulande, Nicolas Servant, Raphaël Rodriguez. Nature Chemistry, le 3 août 2020. DOI:10.1038/s41557-020-0513-5
Version préliminaire, déposée sur bioRxiv le 9 juillet 2019 (https://doi.org/10.1101/693424)