Une interaction protéine-protéine gouverne l’efficacité de ré-initiation de la transcription chez le virus de la rougeole
Une étude pluridisciplinaire, menée par des chercheurs du Centre international de recherche en infectiologie, du laboratoire Architecture et fonction des macromolécules biologiques et du Centre de recherche en cancérologie de Marseille, décrypte le mécanisme moléculaire qui assure une transcription optimisée des ARN messagers du virus de la rougeole requise pour une production équilibrée de chacune des protéines virales. Cette étude qui ouvre de nouvelles perspectives pour concevoir des antiviraux, a été publiée le 9 décembre 2016 dans la revue PloS Pathogens.
Le virus de la rougeole est un membre de la famille des Paramyxoviridae au sein de l’ordre des virus à ARN négatif (Mononegavirales). Cet ordre comprend de très nombreux virus pathogènes pour l’Homme, l’animal ou la plante avec des impacts socioéconomiques et en santé publique majeurs. On peut citer par exemple, les virus de la rage, Ebola, le virus respiratoire syncytial et le virus Nipah. Le génome de ces virus est constitué par de l’ARN négatif non segmenté. Ces virus possèdent un mécanisme de transcription et de réplication très singulier reposant sur trois protéines virales : la polymérase (L), la nucléoprotéine (N) et la phosphoprotéine (P). Chez ces virus, l’ARN génomique n’est pas infectieux car il n’est pas reconnu comme matrice par la polymérase virale. Seul le génome encapsidé dans un homopolymère hélicoïdal de protéines N sert de matrice pour la transcription (c’est-à-dire la production d’ARN messagers – ARNm - qui codent les constituants protéiques du virus) et la réplication du génome viral (c’est-à-dire la production d’une copie complémentaire du génome viral). Cet ensemble, appelé nucléocapside, est reconnu par L via son cofacteur P pour une transcription séquentielle des ARNm qui sont au nombre de six chez le virus de la rougeole. P se lie à la nucléocapside via son domaine terminal (PXD). Ce dernier reconnaît spécifiquement l’extrémité NTAIL de N. Cette extrémité est très souple et assimilable à des poils hérissés au-dessus d’une chenille dont le corps serait la partie relativement rigide de la nucléocapside.
Les six gènes présents dans le génome du virus de la rougeole sont séparés par des régions dites inter-géniques (IGR). Quand la polymérase virale a terminé de transcrire le premier gène (ou gène amont), elle doit reconnaître la région IGR en tant que signal « séparateur » et puis recommencer à transcrire le gène suivant (ou gène aval). L’efficacité de ré-initiation de la transcription diminue au fur et à mesure que la polymérase s’éloigne de l’extrémité 3’ du génome, ce qui donne lieu à un gradient caractéristique d’abondance relative de chaque ARN messager. Pour chaque IGR, l’efficacité avec laquelle la polymérase ré-initie la transcription du gène aval dépend de l’affinité entre l’extrémité souple NTAIL et l’extrémité rigide PXD. Les chercheurs, en combinant des approches de biochimie, biophysique, dynamique moléculaire et biologie cellulaire, ont pu élucider le rôle clé de certains acides aminés de NTAIL dans l’interaction avec PXD. De plus, ils ont pu corréler l’affinité du couple NTAIL-PXD à la capacité de la polymérase à ré-initier la transcription. Ainsi, une faible affinité entre NTAIL et PXD réduit l’efficacité de la polymérase à redémarrer la transcription. Ces études montrent que l’interaction entre NTAIL et PXD est naturellement optimisée pour permettre à la polymérase virale de synthétiser chacun des messagers viraux dans des proportions assurant une production équilibrée de chacune des protéines du virus. Cette interaction serait donc l’une des contraintes majeures auxquelles ce couple protéique a été soumis au cours de l’évolution. Enfin, cette interaction particulière offre une nouvelle cible moléculaire pour concevoir des antiviraux.
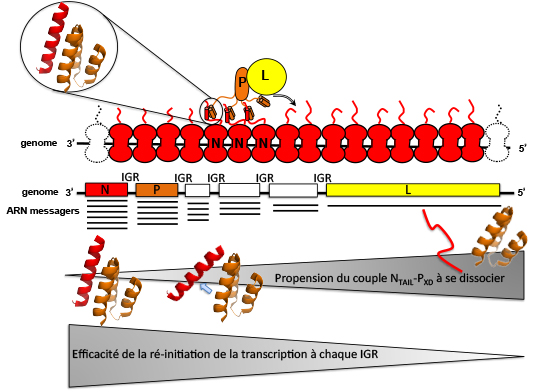
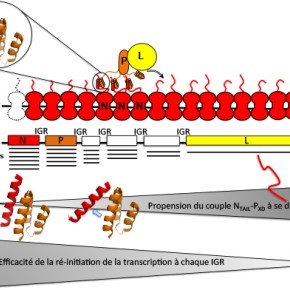
Schéma supérieur : représentation schématique du déplacement de la polymérase virale constituée par la protéine L (en jaune) et la phosphoprotéine (P, en orange) le long de la nucléocapside, à savoir le génome du virus de la rougeole encapsidé par la nucléoprotéine (en rouge). La liaison du complexe L-P à la nucléocapside repose sur l’interaction entre le domaine X de P (PXD) et le domaine NTAIL de N.
Schéma du milieu : organisation schématique du génome du virus de la rougeole avec ses 6 gènes, séparés par des régions inter-géniques (IGRs). Sous chaque gène sont représentés les ARN messagers transcrits à partir de chacun d’eux dans leur abondance relative.
Schéma inférieur : L’efficacité avec laquelle la polymérase virale ré-initie la transcription à chaque IGR dépend de l’affinité du couple NTAIL-PXD. Ainsi, une propension plus prononcée du complexe NTAIL-PXD à la dissociation (de la gauche vers la droite) est associée à une plus faible efficacité de ré-initiation de la transcription.
© Sonia Longhi. Denis Gerlier
En savoir plus
-
Modulation of Re-initiation of Measles Virus Transcription at Intergenic Regions by PXD to NTAIL Binding Strength
Bloyet LM, Brunel J, Dosnon M, Hamon V, Erales J, Gruet A, Lazert C, Bignon C, Roche P, Longhi S, Gerlier D.
PLoS Pathog. 2016 Dec 9;12(12):e1006058. doi: 10.1371/journal.ppat.1006058.