Caractérisation d'une cible antivirale chez le virus Zika
Une étude pluridisciplinaire, menée dans le cadre du projet européen « ZIKAlliance », a permis de caractériser le rôle de la protéine NS5 methyltransférase du virus Zika dans la réplication virale et son échappement au contrôle immunitaire cellulaire. Cette étude publiée le 28 décembre 2016 dans la revue Journal of Virology, montre que les propriétés structurales et fonctionnelles de cette protéine sont communes à celles d'autres virus de la même famille (virus de la dengue, ou de la fièvre jaune), ouvrant la possibilité de développer des inhibiteurs ciblant l'ensemble des virus de cette famille.
L'expansion du virus Zika, notamment sur le continent américain, a attiré l'attention de la communauté scientifique et des services de santé à l'échelle mondiale. Le virus Zika est un arbovirus principalement transmis par les moustiques du genre Aedes. Il appartient aux virus de la famille des flavivirus parmi lesquels on dénombre des pathogènes humains tels que les virus de la fièvre Jaune, de la Dengue ou du Nil Occidental. L'infection par le virus Zika est souvent bénigne mais des complications neurologiques peuvent apparaître chez l'adulte ou chez le fœtus de femmes enceintes. Pour mieux appréhender ce pathogène mal connu et déployer des réponses à son émergence, le projet ZIKAlliance a été créé en réponse à un appel d'offre "Horizon 2020" de la direction générale de la recherche et de l'innovation pour la commission européenne.
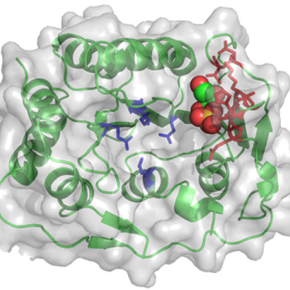
Dans le cadre de ce projet, des chercheurs du laboratoire Architecture Fonction des Macromolécules Biologiques, en collaboration avec des équipes du Centre de Recherche en Cancérologie de Marseille et de l’Institut des Biomolécules Max Mousseron à Montpellier, ont décrypté la structure moléculaire et la fonction biochimique d'une protéine du virus Zika impliquée dans une étape clé de la réplication virale. Cette protéine, appelée méthyltransférase NS5, peut modifier par méthylation le génome du virus pour permettre une production optimale des protéines virales et contrecarrer certains systèmes de défense que la cellule met en place lors de l'infection.
Les résultats obtenus ont permis de montrer que la méthyltransférase NS5 du virus Zika possède des propriétés similaires à celle du virus de la Dengue. Par conséquent, les inhibiteurs de la méthyltransférase du virus de la Dengue découverts ces dernières années sont aussi efficaces contre la méthyltransférase du virus Zika. Cette découverte peut permettre de faire gagner un temps précieux dans la recherche de molécules ciblant cette protéine afin de développer dans le futur des médicaments antiviraux. Par ailleurs, l'analyse de la structure tridimensionnelle a permis de révéler un possible mécanisme catalytique commun à toutes les méthyltransférases NS5 de flavivirus jusqu'alors passé inaperçu. Ce mécanisme est actuellement en cours de validation au laboratoire Architecture et Fonction des Macromolécules Biologiques afin de mieux comprendre certaines étapes de la réplication non seulement chez le virus Zika mais également chez le virus de la Dengue ou d'autres virus à potentiel émergent.
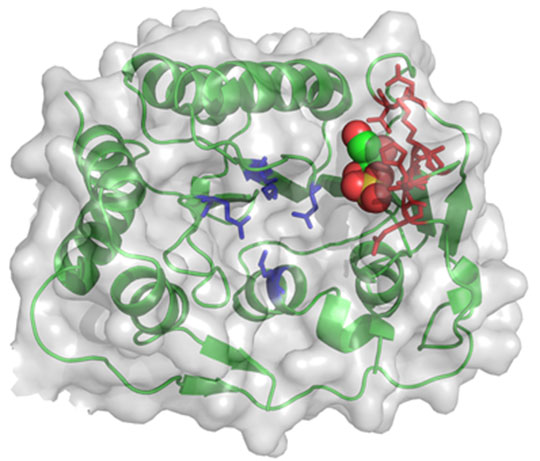
© Bruno Coutard, Karine Barral, Etienne Decroly