Des rapporteurs chimiques pour illuminer les dynamiques de lignification chez les plantes
Les équipes de Christophe Biot et Simon Hawkins de l’Unité de glycobiologie structurale et fonctionnelle, ont développé une méthodologie innovante de double marquage métabolique pour étudier les dynamiques de lignification de la paroi végétale in vivo. Cette étude a été publiée le 2 mars 2017 dans la revue Cell Chemical Biology.
Les cellules des végétaux sont entourées par une paroi composée de plusieurs polymères polysaccharides tels que la cellulose, les hémicelluloses et les pectines. Dans certains tissus (ex. le xylème), les parois cellulaires contiennent également un autre polymère, la lignine, qui peut représenter jusqu'à 25 % de la matière sèche. La présence de la lignine contribue à la résistance mécanique et l'hydrophobicité des cellules du xylème responsable du transport de la sève brute. Ce polymère phénolique joue également un rôle dans la protection des plantes contre divers pathogènes. La lignine est aussi un constituant majeur de la "biomasse lignocellulosique" et impacte fortement la valorisation industrielle de cette source de carbone renouvelable. En effet, la lignine est un des facteurs majeurs responsables de la récalcitrance de la biomasse à la dégradation pendant la production de la bioéthanol. C'est également la lignine qui est largement responsable des propriétés mécaniques du bois. Les recherches sur la biosynthèse et la mise en place de ce polymère sont à la fois intéressantes dans le contexte d'une meilleure compréhension de la biologie des végétaux, mais également représentent un enjeu majeur pour pouvoir, à terme, améliorer la qualité de la biomasse lignocellulosique.
La lignine est issue de la polymérisation oxydante de trois principaux monomères appelés alcools cinnamyliques ou monolignols : l’alcool p-coumarylique, l’alcool coniférylique ainsi que l’alcool sinapylique. Après polymérisation au sein des lignines de la paroi, ils forment respectivement les unités H (hydroxyphényles), G (guaïacyles) et S (syringyles). La lignification est un processus dynamique qui comporte plusieurs étapes. Les monolignols sont d’abord synthétisés dans le cytosol à travers une voie multienzymatique qui débute par un acide aminé, la phénylalanine, avant d’être exportés dans la paroi par des mécanismes de transport encore peu connus (transporteurs, exocytose, diffusion passive). Les monomères phénoliques sont ensuite polymérisés au sein de la paroi grâce à une réaction de couplage radicalaire médiée par enzymes oxydoréductrices de type laccase et/ou peroxydase. Ces monolignols peuvent également former des liaisons covalentes avec les hémicelluloses de la paroi afin de rigidifier cette dernière. La lignification est un processus complexe car la composition et la quantité de monolignol varie selon l’espèce végétale, le stade de développement, le tissu ou encore les conditions environnementales. S’il a été démontré que ce processus est étroitement régulé in vivo, de nombreuses questions qui concernent notamment la régulation spatio-temporelle ainsi que la cinétique de la lignification, restent en suspend.
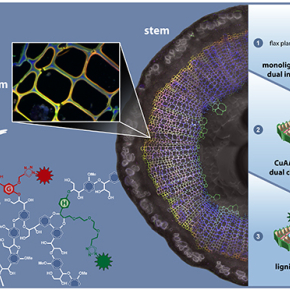
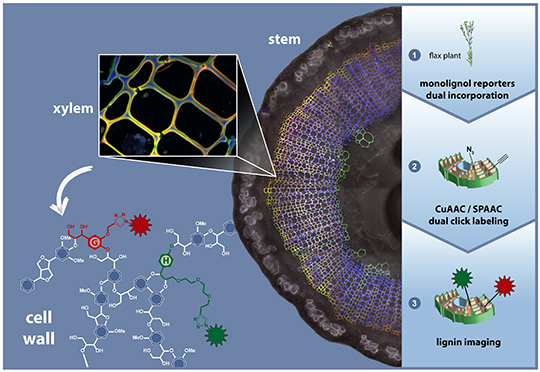
Dans cette étude, les chercheurs rapportent une méthode innovante de marquage métabolique multiple pour visualiser la lignification de la paroi cellulaire végétale in vivo par microscopie confocale de fluorescence. Cette approche, intitulée BLISS pour bioorthogonal labeling imaging sequential strategy, utilise deux analogues de précurseur de lignine H et G modifiés respectivement par une fonction azoture et un groupement alcyne qui peuvent être indépendamment incorporés dans les parois cellulaires, puis différentiellement dérivatisés in vivo par l’intermédiaire de deux réactions de ligation bioorthogonale.
La stratégie BLISS fournit des informations spatiales précises sur les zones de la lignification active et révèle une polarisation importante dans les dynamiques de la lignification.
© Cedric Lion
En savoir plus
-
BLISS: A Bioorthogonal Dual-Labeling Strategy to Unravel Lignification Dynamics in Plants.
Lion C, Simon C, Huss B, Blervacq AS, Tirot L, Toybou D, Spriet C, Slomianny C, Guerardel Y, Hawkins S, Biot C.
Cell Chem Biol. 2017 Mar 16;24(3):326-338. doi: 10.1016/j.chembiol.2017.02.009. Epub 2017 Mar 2.