Des PASTA sinon rien !
L’équipe de Christophe Grangeasse du laboratoire de Microbiologie moléculaire et biochimie structurale, revisite le rôle des domaines PASTA dans la division cellulaire bactérienne. Ces travaux publiés le 4 décembre 2017 dans la revue Nature Microbiology, révèlent une fonction complétement inédite de ces domaines dans l'organisation et l'hydrolyse de la paroi cellulaire. Ils ouvrent la voie à de nouvelles applications biomédicales et industrielles.
Les domaines PASTAs (pour penicillin-binding protein and serine/threonine kinase associated domain) sont retrouvés exclusivement chez les bactéries, notamment au niveau de protéine-kinases membranaires impliquées dans la régulation du cycle cellulaire bactérien. Depuis leur identification, il est proposé que la propriété principale des domaines PASTA est de fixer certains antibiotiques et autres molécules structuralement comparables, comme les fragments de la paroi cellulaire. Sur cette base, les protéine-kinases possédant des domaines PASTA sont considérées comme de véritables récepteurs membranaires signalant l'état de la paroi cellulaire et contrôlant la division et la morphogenèse cellulaire.
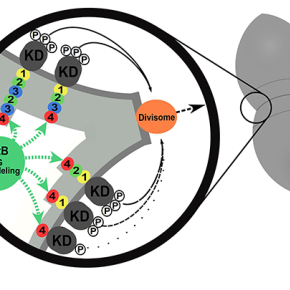
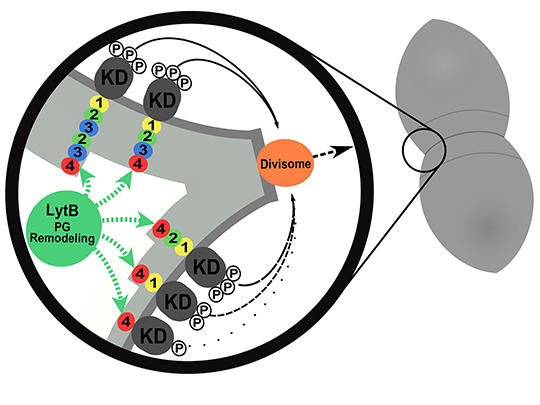
L'équipe de C. Grangeasse s'intéresse depuis plusieurs années au rôle régulateur de la protéine-kinase StkP dans la division cellulaire de la bactérie Streptococcus pneumoniae (ou pneumocoque). StkP est ainsi le chef d'orchestre de ce processus en contrôlant et coordonnant, l'allongement cellulaire, le positionnement du site de division et la constriction cellulaire. Le domaine extracellulaire de cette protéine-kinase est composé de la répétition de 4 domaines PASTA dont on ne connaissait pas la fonction exacte. Un modèle proposait néanmoins qu'ils permettraient l'activation de StkP en fixant des fragments de la paroi cellulaire.
Au cours d'une véritable partie de Lego moléculaire, les chercheurs ont supprimé, inversé, échangé, mélangé ou encore inséré des domaines PASTA additionnels et ensuite quantifié l'impact de ces manipulations génétiques sur la division cellulaire du pneumocoque. Il est alors apparu que les 4 domaines PASTA de StkP n'étaient pas équivalents. Plus précisément, le quatrième domaine en position distale possède une propriété particulière permettant la localisation de StkP au site de division, la constriction cellulaire et la séparation finale des cellules filles. Les 3 autres domaines PASTA placés entre la membrane de la cellule et le PASTA4, agissent comme une règle moléculaire permettant de définir l'épaisseur de la paroi cellulaire entourant la cellule et de contrôler le niveau d'activation de StkP indépendamment de la fixation de fragments de la paroi.
L'histoire a alors pris une ampleur supplémentaire avec la caractérisation structurale du domaine PASTA4 en collaboration avec l’équipe de Patrice Gouet (Laboratoire de Microbiologie Moléculaire et Biochimie Structurale, CNRS/Université Claude Bernard Lyon I). Cette structure montre un motif uniquement présent au niveau du domaine PASTA 4. Les chercheurs ont alors démontré que ce motif en forme de "main crochue" est spécifiquement impliqué dans l'interaction avec une hydrolase de la paroi cellulaire permettant la séparation finale des cellules filles. La collaboration avec l’équipe de Céline Brochier-Armanet (Laboratoire de Biométrie et Biologie Evolutive, INRIA/CNRS/Université Claude Bernard Lyon I), a mis en évidence que ces résultats pouvaient être transposés à d'autres espèces bactériennes établissant ainsi un nouveau modèle du rôle des protéine-kinases à domaines PASTA dans la régulation de la division et la morphogenèse de la cellule bactérienne.
Les domaines PASTA sont exclusivement retrouvés chez les bactéries. Les propriétés structurales particulières de l'un d'entre eux, situé de plus en surface de la cellule bactérienne et facilement accessible, laisse donc entrevoir des applications aussi bien biomédicales qu’industrielles. La mise en place de stratégies influençant la fonction du domaine PASTA distal devrait permettre de manipuler les capacités de multiplication des bactéries offrant ainsi des approches nouvelles pour lutter contre les infections bactériennes ou encore contrôler la production de molécules d'intérêt industriel.
© Laure Zucchini
En savoir plus