UreG, une enzyme qui a besoin de désordre pour fonctionner
« La vie cellulaire a besoin de désordre : certaines enzymes doivent rester flexibles pour fonctionner correctement et nécessitent une structure désordonnée. Si l’enzyme intrinsèquement désordonnée UreG est forcée dans une structure tridimensionnelle trop rigide elle perd complètement sa capacité à agir. » Telles sont les conclusions d’une étude menée par Elisabetta Mileo au Laboratoire de bioénergétique et ingénierie des protéines, en collaboration avec l'équipe de Barbara Zambelli à l’Université de Bologne (Italie). Cette étude a été publiée le 20 juillet 2017 dans la revue Scientific Reports
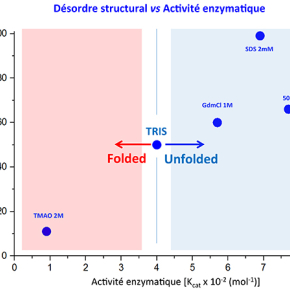
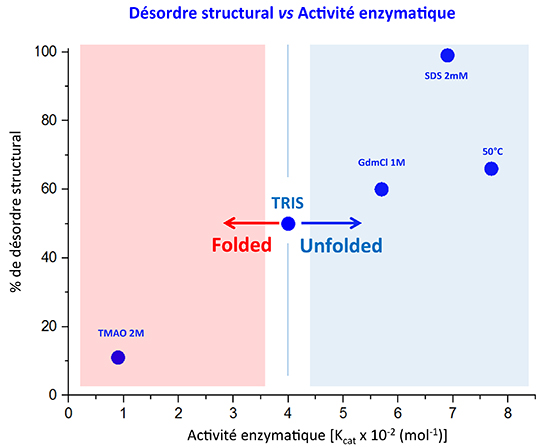
Elle s’appelle UreG et c'est une enzyme permettant l’insertion du nickel dans l’uréase, une protéine impliquée dans la pathogénicité de certaines bactéries, telles que Helicobacter pylori, l’agent responsable de l’ulcère gastrique. Il y a quelques années, les chercheurs avaient déjà montré que UreG n’a pas une structure unique, mais fluctue au travers d’un ensemble continu de conformations. Dans cette nouvelle étude, ils ont étudié ce qu’il se passe lorsque cette flexibilité est altérée sous l’influence de composés modifiant la rigidité structurale des protéines. En combinant les techniques de marquage paramagnétique couplé à la RPE, la RMN et des tests d’activité, les deux équipes ont analysé en détail la relation entre plasticité structurale et activité enzymatique. Leurs résultats montrent que si UreG est maintenue dans une structure tridimensionnelle trop rigide, elle perd complètement sa capacité à agir, et qu’une certaine fenêtre de flexibilité structurale est nécessaire pour une activité optimale.
Les protéines intrinsèquement désordonnées ont fait leur irruption en Biologie il y a une quinzaine d’années. Jusque-là, désordre structural rimait avec dénaturation, mais un nombre croissant de systèmes ont été identifiés dans lesquels le désordre, avec les multiples transitions structurales qu’il permet, joue un rôle fonctionnel essentiel : signalisation cellulaire, régulation, reconnaissance entre partenaires, etc., autant de domaines où les systèmes désordonnés ou partiellement désordonnés assurent des fonctions clés. A l’inverse, dans les systèmes enzymatiques, la précision structurale semblait de rigueur, et la relation structure-fonction (avec le modèle « clé-serrure »), le paradigme permettant de comprendre la spécificité de substrat et la sélectivité catalytique. Les travaux récents menés par la collaboration franco-italienne sur l’enzyme UreG viennent de battre en brèche cette vision. Ce résultat surprenant révèle ainsi le rôle émergent que les hétérogénéités structurales et l’échantillonnage conformationnel peuvent avoir dans l’activité de certaines enzymes.
Ce changement de paradigme renouvelle fortement notre compréhension du rôle de la dynamique protéique dans la fonction et l’évolution des enzymes. Il pourrait également avoir des retombées importantes en recherche pharmaceutique en ouvrant de nouvelles perspectives pour le développement d’inhibiteurs enzymatiques, actuellement basé sur une vision rigide des interactions entre principes actifs et enzymes cibles.
© Elisabetta Mileo
En savoir plus
-
The relationship between folding and activity in UreG, an intrinsically disordered enzyme.
Palombo M, Bonucci A, Etienne E, Ciurli S, Uversky VN, Guigliarelli B, Belle V, Mileo E, Zambelli B.
Sci Rep. 2017 Jul 20;7(1):5977. doi: 10.1038/s41598-017-06330-9.