Les cassures double-brin de l’ADN prennent des risques
L'ADN de nos cellules est régulièrement endommagé et parmi les lésions les plus dangereuses, les cassures qui touchent les deux brins de la double hélice d'ADN peuvent conduire à des échanges d'ADN entre des chromosomes différents, appelés translocations. Des chercheurs du Laboratoire de biologie cellulaire et moléculaire du contrôle de la prolifération, en collaboration avec une équipe du Babraham Institute à Cambridge (Grande-Bretagne), montrent que les cassures double-brin de l'ADN peuvent dans certains cas se regrouper dans le noyau des cellules, ce qui pourrait contribuer à l'apparition des translocations. Ces travaux ont été publiés le 6 mars 2017 dans la revue Nature Structural and Molecular Biology.
Les translocations chromosomiques représentent des évènements dangereux souvent associés à l’initiation et la progression tumorale, mais les causes conduisant à leur formation restent encore peu comprises. La juxtaposition dans le noyau des cellules de deux cassures double-brin de l’ADN pourrait favoriser l'apparition des translocations. La capacité de deux ou plusieurs cassures double-brin à se « regrouper » dans le noyau est une hypothèse qui a été très largement étudiée et débattue au cours des dernières années.
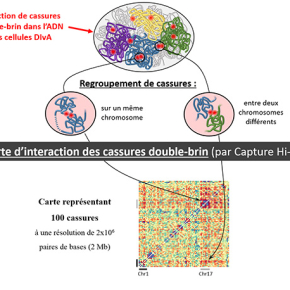
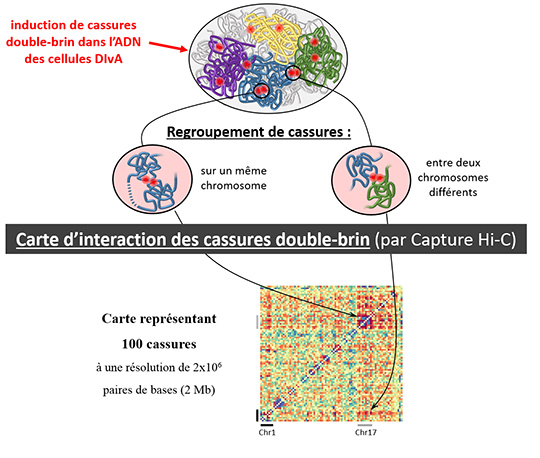
Afin d’aborder cette question, l’équipe de Gaëlle Legube, au Centre de Biologie Intégrative de Toulouse, en collaboration avec l’équipe de Peter Fraser du Babraham Institute à Cambridge, utilise une technologie de pointe qui permet de cartographier, à haute résolution et à l’échelle du génome entier, les interactions physiques entre différentes régions de l’ADN chromosomique. Cette technologie récente, appelée Capture Hi-C, est ici combinée avec un système original d’induction des cassures double-brin de l'ADN à des endroits annotés du génome (le système cellulaire DIvA).
Les résultats obtenus par les chercheurs indiquent que de multiples cassures double-brin peuvent en effet se regrouper au sein du noyau. Cependant, ils montrent que cela n’est pas une caractéristique générale qui s’applique à toutes les cassures double-brin, mais seulement à celles provoquées dans les régions actives du génome (c'est à dire où l'ADN est en cours de transcription). Ce regroupement des cassures chromosomiques dépend de protéines du squelette nucléaire ou cytoplasmique, ce qui pourrait suggérer que des mécanismes actifs sont à l’œuvre dans ce processus.
Il est important de souligner que l'étude montre aussi que ce regroupement des cassures double-brin qui surviennent dans les gènes actifs, coïncide avec un défaut de réparation de l'ADN cassé, et cela particulièrement au cours de la phase G1 du cycle cellulaire. Etant donné que, d’une part, la plupart des cellules de notre organisme sont arrêtées en phase G1 et que, d’autre part, les régions actives du génome émergent comme étant particulièrement fragiles, il devient donc nécessaire de prendre en compte ce comportement particulier des cassures double-brin de l’ADN dans notre vision des translocations chromosomiques.
En outre, ces travaux pourraient avoir des répercussions sur les traitements chimiothérapeutiques, puisque l’une des stratégies de choix en chimiothérapie consiste en l’utilisation de drogues génotoxiques, c'est à dire qui endommagent l’ADN des cellules, et que les protéines du cytosquelette sont également la cible de multiples traitements anti-cancéreux. Il est donc important d’intégrer ces nouveaux concepts dans la réflexion sur les effets indésirables de ces traitements (intolérance, apparition d'une résistance ou de tumeurs secondaires).
© François Aymard. Gaëlle Legube
En savoir plus
-
Genome-wide mapping of long-range contacts unveils clustering of DNA double-strand breaks at damaged active genes
Nat Struct Mol Biol. 2017 Mar 6. doi: 10.1038/nsmb.3387
Aymard F, Aguirrebengoa M, Guillou E, Javierre BM, Bugler B, Arnould C, Rocher V, Iacovoni JS, Biernacka A, Skrzypczak M, Ginalski K, Rowicka M, Fraser P, Legube G.