Un lien entre "plasticité calcique" des cellules cancéreuses et pouvoir métastatique révélé
La capacité des cellules cancéreuses à envahir l’organisme trouve son origine dans un extraordinaire pouvoir d’adaptation. Les équipes d'Olivier Soriani à l'institut de biologie Valrose et de Christophe Vandier de l'unité Nutrition, croissance et cancer, identifient un mécanisme très particulier qui permet aux cellules cancéreuses d’augmenter leur pouvoir métastatique en adaptant leur « signature calcique ». Au coeur de ce mécanisme, une protéine chaperon, SigmaR1, orchestre l’expression des canaux calciques à la membrane des cellules. Cette étude a été publiée le 23 janvier 2017 dans la revue Oncogene.
Il est désormais admis que le caractère invasif d’un cancer primitif est déterminé non seulement par le génotype des cellules tumorales, mais également par leur capacité à s’adapter aux conditions de stress qu’elles subissent au sein du micro environnement tumoral. Ainsi, la compréhension des mécanismes qui régissent cette capacité d’adaptation propre aux cellules cancéreuses est un enjeu majeur pour la mise au point de traitements efficaces.
L’ion calcium intervient dans de nombreux processus. On connait son rôle dans la construction osseuse, mais il faut ajouter une fonction de signalisation qui se décline sur une palette très large de processus allant de la fécondation à la mort programmée des cellules. On peut y inclure, entre autres, la contraction musculaire et cardiaque, l’intégration du message nerveux, la sécrétion hormonale ou encore la migration cellulaire. Une telle diversité de fonctions à partir d’une seule espèce ionique s’explique par le codage, au sein de la cellule, du signal calcique selon des critères de fréquence, d’intensité et de localisation dans l’espace intra cellulaire.
L’organisation dynamique et spatiale des canaux ioniques, protéines membranaires qui conditionnent le passage des ions de l’extérieur vers l’intérieur de la cellule, est déterminante dans l’établissement d’une « signature calcique » associée à chaque type cellulaire. Des études très récentes ont démontré que la signature calcique des cellules cancéreuses subissait de profondes modifications associées au développement de la maladie.
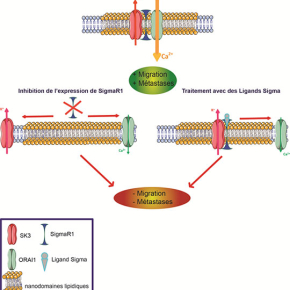
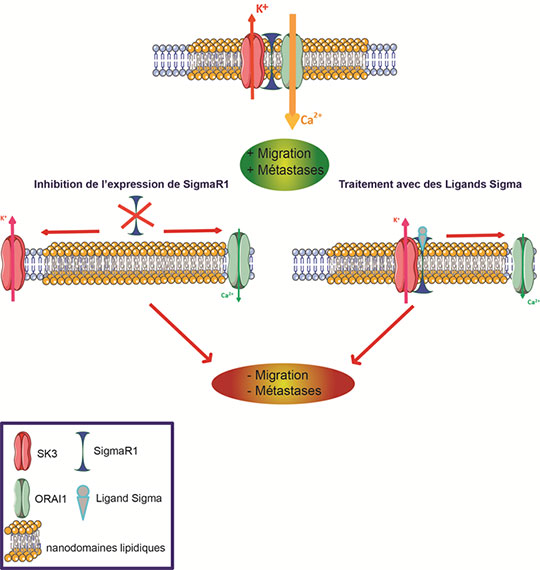
L’équipe de Christophe Vandier à Tours avait démontré récemment que deux canaux, potassique et calcique, nommés respectivement SK3 et Orai1, sont associés dans des régions membranaires appelées "nanodomaines lipidiques", et que ce couplage est étroitement lié à la présence de métastases osseuses. De fait, ces deux canaux s’associent pour contrôler très finement et très localement l’influx calcique à la faveur d’un potentiel migratoire et métastatique accru. Restait alors à déterminer les mécanismes régulant l’association physique de ces canaux dans les membranes des cellules malades.
SigmaR1 est une protéine qui fait actuellement l’objet de recherches intenses dans le cadre de pathologies du système nerveux telles que les maladies neurodégénératives (Alzheimer, maladie de Charcot, dégénérescence maculaire), l’addiction à la cocaïne et les accidents vasculaires cérébraux. Protéine discrète dans les tissus en bonne santé, l’activité de SigmaR1 ne se révèle que dans les tissus touchés par la maladie. Cette protéine « chaperon » s’associe alors à des protéines de signalisation (récepteurs membranaires, canaux ioniques) pour adapter le comportement des neurones aux perturbations imposées par l’évolution de la maladie, et promouvoir la survie des cellules.
Pionnière dans l’étude des interactions entre SigmaR1 et les canaux ioniques, l’équipe d’Olivier Soriani a démontré, en collaboration étroite avec l’équipe de Christophe Vandier, que c’est en fait la présence de SigmaR1 qui conditionne la formation de complexes SK3 :Orai1 dans les cancers du sein et du colon, et leur localisation dans les nanodomaines lipidiques de la membrane des cellules. Les chercheurs ont mis en évidence un fait majeur : l’inhibition de l’activité de SigmaR1 par l’utilisation de petites molécules appelées « ligands sigma » empêche la formation de ces complexes, et annihile le potentiel migratoire et métastatique des cellules in vitro.
Enthousiasmés par ces résultats prometteurs, les chercheurs se sont tournés vers des cliniciens de Brest, Nantes et Tours pour tenter de mettre en lumière un lien entre la présence de SigmaR1 chez les patients et des paramètres tels que la survie ou le grade de la tumeur. En accord avec le mécanisme observé au laboratoire, la survie des patientes atteintes de cancers du sein est très significativement diminuée lorsque qu’on détecte une forte présence de SigmaR1. De plus, l’expression de SigmaR1 est statistiquement plus élevée dans les tumeurs du colon de haut grade.
Le ciblage de cette petite protéine avec des « ligands sigma », actuellement en cours de développement, pourrait permettre à terme de réduire la « plasticité calcique » des cellules malades, et réduire ainsi leur potentiel agressif.
© Maéva Gesson, Plateforme PRISM, Institut de Biologie Valrose
Vignette : Cellule en phase migratoire
© Maéva Gesson