Mieux comprendre l’absence de production de spermatozoïdes pour traiter l’infertilité
Des chercheurs de l’institut pour l’avancée des biosciences ont découvert une nouvelle cause génétique de l’infertilité masculine humaine. Ils révèlent que l’oligo- et l’azoospermie peuvent représenter un continuum pathologique lorsque le gène SPINK2 est muté. Ceci permet d’envisager de nouvelles stratégies de traitement des patients pour lesquels aucune solution thérapeutique n’existe. Cette étude a été publiée le 29 mai 2017 dans la revue EMBO Molecular Medicine.
De nombreux couples font face à des difficultés pour concevoir, avec une atteinte fonctionnelle retrouvée à peu près à parts égales chez l’homme ou la femme, et un couple sur 7 consulte dans un service spécialisé pour sous-fertilité ou infertilité. Les causes d’infertilité sont multiples et incluent l’environnement, les infections, l’âge, les troubles immunitaires ou - et ce facteur pourrait être prépondérant - des anomalies génétiques. Pour les patients présentant les troubles les plus sévères, les équipes soignantes mettent en œuvre les techniques de procréation médicalement assistée (PMA) comme la fécondation in vitro (FIV) ou la micro-injection directe d’un spermatozoïde dans l’ovocyte (ou ICSI, pour intracytoplasmic sperm injection). Malheureusement, ces techniques palliatives ne permettent pas de répondre à toutes les causes d’infertilité et près d’un couple sur deux restera sans enfants après un parcours de soin éprouvant.
Parmi les cas les plus sévères d’infertilité, on trouve les patients souffrant d’incapacité à produire un nombre suffisant de gamètes. Pour l’homme on parle d’oligozoospermie quand le nombre des spermatozoïdes est très bas, et d’azoospermie quand aucun spermatozoïde n’est retrouvé dans l’éjaculat. Dans ce dernier cas les techniques de PMA sont inefficaces.
L’équipe de Christophe Arnoult et Pierre Ray a constitué une cohorte unique de patients infertiles (homme et femme) et réalise pour chaque patient un séquençage exomique complet de l’ADN. Cette technique permet de séquencer la totalité des séquences géniques qui ne constituent qu’environ 1% du génome humain mais dans lesquelles on retrouve plus de 90% des anomalies génétiques responsables de pathologies humaines. Chaque individu est porteur d’environ 30 000 variants par rapport à la séquence nucléotidique consensus humaine et la difficulté est alors d’identifier le ou les variants responsables de la pathologie. L’analyse des séquences exomiques d’hommes présentant des anomalies morphologiques et fonctionnelles du spermatozoïde avait déjà permis à l’équipe de découvrir et de caractériser la fonction de plusieurs gènes impliqués dans la spermatogénèse (AURKC, DPY19L2, DNAH1, PLCzeta) 1
.
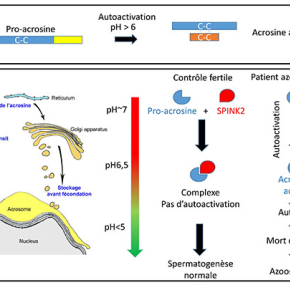
Dans cette étude, les chercheurs identifient un nouveau gène impliqué dans l’azoospermie, la forme la plus sévère d’infertilité masculine. Ce gène appelé SPINK2, code une protéine permettant de réguler l’activité protéasique au cours de la spermatogénèse. En effet, après la méiose, le précurseur du spermatozoïde synthétise une grande quantité de protéases qui seront nécessaires à la traversée des couches protectrices de l’ovocyte. Parmi ces enzymes, la mieux caractérisée est l’acrosine. Bien que synthétisée sous une forme inactive pour limiter l’auto-digestion, l’acrosine est capable de s’auto-activer et de léser les cellules en formation. Pour limiter cette auto-digestion, le spermatozoïde synthétise simultanément l’acrosine et son inhibiteur, la protéine SPINK2. Chez certains patients souffrant d’azoospermie, les chercheurs montrent que le gène SPINK2 est muté à l’état homozygote (les deux copies du gène sont mutées), entrainant la production d’une protéine tronquée et inactive. Les conséquences en sont très graves et incluent des lésions cellulaires, un arrêt de la spermatogénèse et une azoospermie complète chez le patient. La recherche de mutations du gène SPINK2 dans une cohorte de 611 patients souffrant d’oligo- ou d’azoospermie a montré que lorsque ce gène est muté à l’état hétérozygote (une seule copie du gène est mutée), ceci entraine un phénotype modéré d’oligospermie. Ces résultats ont été confirmés dans un modèle de souris chez lequel l’invalidation du gène Spink2 (Spink2 KO) reproduit parfaitement la pathologie humaine.
En conclusion, ces résultats sont intéressant à plusieurs titres :
- Peu de causes d’azoospermie sont connues. Celles décrites précédemment impliquaient généralement des arrêts de la multiplication des spermatogonies ou un arrêt de la méiose. La caractérisation d’une cause post-méiotique d’azoospermie est remarquable.
- L’oligo- et l’azoospermie peuvent représenter un continuum pathologique lorsque le gène SPINK2 est muté. Dans le cas décrit dans cette étude, deux pathologies ne sont donc que l’expression d’une même maladie.
- La découverte du gène impliqué et des mécanismes moléculaires mis en jeu dans ces cas d’azoospermie permettent d’envisager de nouvelles stratégies thérapeutiques pour les patients pour lesquels aucune solution thérapeutique n’est actuellement possible. Ceci conduit maintenant les chercheurs à tester plusieurs hypothèses pour tenter de rétablir une spermatogenèse fonctionnelle dans le modèle de souris Spink2 KO.
- 1Mitchell M.J. et al. Clin Genet. 2017 Feb;91(2):208-216. doi: 10.1111/cge.12900.