Le senseur énergétique AMPK régule le devenir des cellules souches musculaires adultes
Au cours de la régénération du muscle, une partie des cellules souches musculaires s’auto-renouvelle et retourne à un état de quiescence. Le contrôle de cet état est primordial pour l’équilibre du muscle squelettique. L'équipe de Rémi Mounier à l'Institut Neuromyogène, met en évidence que le senseur énergétique AMPK régule le retour à la quiescence des cellules souches musculaires via la régulation de l’activité d’une enzyme clé du métabolisme glycolytique : la lactate déshydrogénase. Cette étude publiée le 17 mai 2017 dans la revue EMBO Journal, ouvre la voie à la caractérisation d'agents pharmacologiques modulateurs de l'homéostasie des cellules souches musculaires et utilisables pour le traitement des myopathies dégénératives.
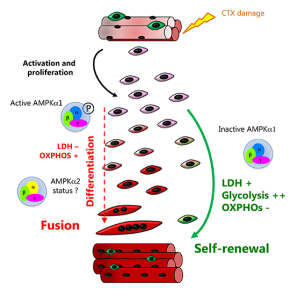
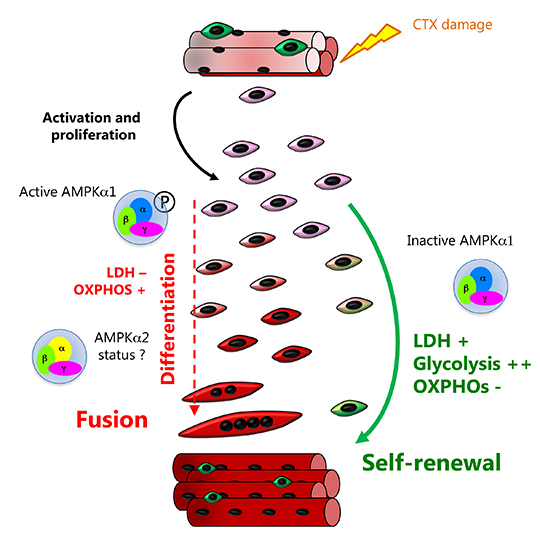
Dans le muscle squelettique sain adulte, les cellules souches musculaires (cellules satellites) sont quiescentes sous la lame basale tout le long de la fibre musculaire. Après une blessure, ces cellules s’activent, prolifèrent puis sont capables de se différencier pour réparer les myofibres endommagées. Elles peuvent aussi s’auto-renouveler et retourner à un état de quiescence afin de reconstituer la réserve de cellules souches. Les voies moléculaires qui contrôlent le retour à la quiescence sont donc essentielles à l'homéostasie du muscle tout au long de la vie. Elles ont commencé à être identifiées au cours des toutes dernières années seulement. Dans d’autres tissus, comme la moelle osseuse, la régulation du devenir des cellules souches dépend de leur métabolisme.
L'AMPK (5'AMP kinase) est un senseur énergétique coordonnant les processus consommateurs et producteurs d’énergie. C'est un senseur du niveau d'AMP dans la cellule qui induit une réponse catabolique quand celui-ci est trop élevé. De par ses fonctions régulatrices aux niveaux énergétique, métabolique et du cycle cellulaire, l’AMPK est un bon candidat pour le contrôle du choix entre différenciation et auto-renouvellement des cellules souches musculaires.
Différents systèmes expérimentaux complémentaires ont été mis en œuvre in vivo (modèles murins déficients pour l’AMPK spécifiquement dans les cellules souches musculaires ou dans les myofibres), ex vivo(myofibres isolées) et in vitro (cultures primaires), couplés à une approche pharmacologique. Les différentes phases du devenir des cellules souches, après un dommage musculaire, ont pu ainsi être explorées : prolifération, différenciation et auto-renouvellement/retour à la quiescence.
Les chercheurs montrent que le senseur énergétique AMPK contrôle le retour à la quiescence (ou auto-renouvellement) des cellules souches musculaires. En effet, les cellules souches musculaires déficientes pour l'AMPKa1 s'auto-renouvellent plus, induisant une altération de la régénération musculaire. En outre, ces cellules souches déficientes pour l'AMPKa1 ont un métabolisme principalement glycolytique. Cette augmentation du métabolisme glycolytique et de la régulation de l'auto-renouvellement est médiée par la lactate déshydrogénase (LDH), une enzyme non limitante dans les cellules différenciées, qui présente une activité fortement augmentée dans les cellules souches invalidées pour le gène de l'AMPKa1. Enfin, ils montrent que des nutriments spécifiques du métabolisme glycolytique ou oxydatif contrôlent directement le devenir des cellules souches musculaires via la voie de signalisation AMPKa1/LDH, attestant l'importance du métabolisme dans ce processus.
Ces travaux pourraient permettre de mettre en évidence de nouveaux régulateurs de l'homéostasie des cellules souches musculaires, facteur pouvant être modulé pharmacologiquement. Ceci est particulièrement intéressant au regard d'études récentes mettant en évidence un effet bénéfique de l’activation de l’AMPK dans les myopathies dégénératives, caractérisées par des cycles permanents de régénération.
© Marine Theret/Rémi Mounier
En savoir plus
-
AMPKα1-LDH pathway regulates muscle stem cell self-renewal by controlling metabolic homeostasis.
Theret M, Gsaier L, Schaffer B, Juban G, Ben Larbi S, Weiss-Gayet M, Bultot L, Collodet C, Foretz M, Desplanches D, Sanz P, Zang Z, Yang L, Vial G, Viollet B, Sakamoto K, Brunet A, Chazaud B, Mounier R.
EMBO J. 2017 Jul 3;36(13):1946-1962. doi: 10.15252/embj.201695273. Epub 2017 May 17