Une polypharmacologie conceptualisée rationnellement au secours des résistances aux traitements en cancérologie
Les équipes de Xavier Morelli et Patrice Dubreuil du Centre de recherche en cancérologie de Marseille, en collaboration avec la société pharmaceutique AB Science, ont mis en évidence une propriété surprenante d’une certaine classe de médicament inhibiteurs de protéines tyrosine kinases, qui peuvent se montrer d’une grande utilité thérapeutique dans la course à la résistance aux traitements en cancérologie. Cette étude a été publiée le 10 novembre 2017 dans la revue Nature Communication.
Depuis maintenant une décennie, le développement de nouveaux médicaments et l’identification de nouvelles cibles thérapeutiques a subi un énorme progrès grâce aux grandes avancées technologiques réalisées dans les domaines de la génomique, de la protéomique et de la biologie structurale. Ceci a permis l’identification de molécules très actives et sélectives pour le traitement de cancers et d’autres pathologies, telles que les maladies inflammatoires chroniques et les infections virales.
Le développement clinique et l’autorisation de mise sur le marché de médicaments tels que le Gleevecâ (imatinib) pour les leucémies myéloïdes chroniques et les tumeurs stromales gastro-intestinales (GIST), a révolutionné le traitement de ces cancers et a validé le concept de thérapie ciblée. Malheureusement, après plusieurs années de recul, ce type de traitements commence à atteindre ses limites à cause de l’apparition de résistances dans le cas de traitements de longue durée. D’autre part, malgré le concept de thérapie ciblée, ce type de traitement chronique produit souvent des effets toxiques dus à l’activité sur des cibles non identifiées. Ces effets souvent négatifs sur des cibles secondaires, pourraient aussi produire des effets thérapeutiques bénéfiques pour le traitement des maladies. C’est ce que viennent de démontrer les équipes de Xavier Morelli et Patrice Dubreuil, en collaboration avec la société pharmaceutique AB Science.
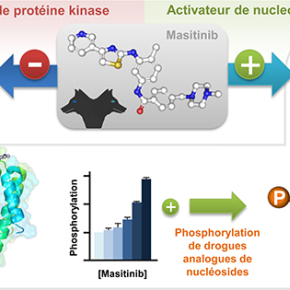
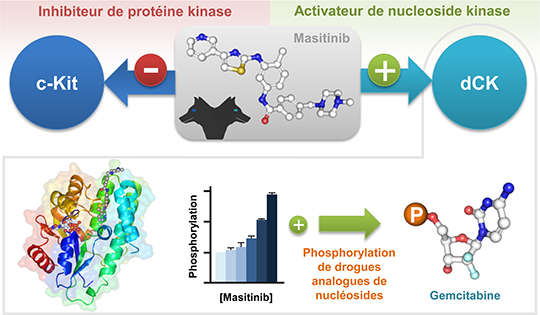
Le masitinib, un inhibiteur de protéines tyrosine kinases (TKI) dirigé contre les protéines à activité tyrosine kinase c-Kit, c-fms, PDGFRα/β, Lyn et Fyn, a récemment montré une grande efficacité dans les essais cliniques concernant des pathologies impliquant ces kinases cibles (Mastocytose, GIST, Maladie de Charcot). Il possède, en dehors de son activité ciblée, une activité indéniable dans la re-sensibilisation des cellules tumorales résistantes à la chimiothérapie lorsqu'il est combiné à certaines chimiothérapies et particulièrement la gemcitabine. Cette propriété a été confirmée avec la combinaison masitinib/gemcitabine dans une étude clinique de phase III pour le traitement de patients souffrant de cancers du pancréas avancés.
En cherchant à identifier les voies de signalisation impliquées dans la re-sensibilisation aux chimiothérapies par l’action du masitinib, l’équipe de Patrice Dubreuil a démontré que l'amélioration de l’activité anti-tumorale observée n’était pas liée aux cibles connues du masitinib. Pour cela, les chercheurs ont mis au point une méthode pour l’identification de l’ensemble des cibles protéiques du masitinib par une approche de protéomique inverse. Cette technique a permis d'identifier de nouvelles cibles potentielles pour le masitinib dont la désoxycytidine kinase humaine (dCK). Cette nucléoside kinase est une enzyme clé dans la biosynthèse de nucléotides par la voie dite de sauvetage, mais elle est également une protéine très importante pour la phosphorylation et l'activation de certains antiviraux et de molécules utilisées en chimiothérapie anticancéreuse. A cause de son rôle dans l’activation de pro-drogues, l’absence de dCK est associée à des résistances à certains médicaments de la famille des analogues de nucléoside, comme la gemcitabine. Afin de vérifier si dCK était directement impliquée dans la réponse cytotoxique induite par le traitement combiné gemcitabine et masitinib in vitro, les chercheurs ont alors étudié son niveau d'expression dans plusieurs lignées cellulaires. Ils ont pu confirmer ainsi que l'effet synergique du co-traitement était dépendant de l'expression de dCK.
L’histoire prend une toute autre direction lorsqu’une étude intégrée en Biologie Structurale et Chimie-Biologie réalisée dans l’équipe de Xavier Morelli, décrit au niveau moléculaire l’interaction spécifique du masitinib avec dCK, mais aussi avec d’autres inhibiteurs de tyrosine kinases, comme l’imatinib (Gleevecâ), inspirant un processus généralisable à d’autres inhibiteurs de tyrosine kinases, dont certains ont déjà une autorisation de mise sur le marché.
Cette étude originale met en évidence une nouvelle propriété de certaines molécules pouvant se montrer de grande utilité thérapeutique. Le masitinib et l'imatinib, deux molécules inhibitrices de protéines kinases, peuvent jouer en même temps le rôle d’activateurs de la nucléoside kinase dCK et d’inhibiteurs de protéines kinases et agir comme des molécules à activités duales tel Orthos, le chien à deux têtes de la mythologie grecque. Grâce à cette dualité, certains agents utilisés en chimiothérapie pourraient conserver leur efficacité à plus faibles doses permettant ainsi une réduction de leur toxicité. De plus, l’activation de dCK pourrait aussi permettre de contourner les phénomènes de résistance à certains médicaments qui s'opèrent via la diminution d’expression de cette kinase.
© Magali Saez-Ayala, Stéphane Betzi
En savoir plus
-
Dual protein kinase and nucleoside kinase modulators for rationally designed polypharmacology.
Kahina Hammam, Magali Saez-Ayala, Etienne Rebuffet, Laurent Gros, Sophie Lopez, Berengere Hajem, Martine Humbert, Emilie Baudelet, Stephane Audebert, Stephane Betzi, Adrien Lugari, Sebastien Combes, Sebastien Letard, Nathalie Casteran, Colin Mansfield, Alain Moussy, Paulo de Sepulveda, Xavier Morelli & Patrice Dubreuil.
Nature Communications 8, Article number: 1420 (2017). doi:10.1038/s41467-017-01582-5. Published online: 10 November 2017