MacP, un régulateur de l'assemblage de la paroi bactérienne : vers une nouvelle cible thérapeutique ?
Les PBPs, pour penicillin-binding proteins, sont la cible des antibiotiques de type beta-lactam qui sont couramment utilisés. Cependant, les mutations au niveau de ces enzymes sont souvent à l'origine de la résistance de bactéries pathogènes à ces traitements. En collaboration avec les équipes de David Rudner et Thomas Bernhardt de l'Université de Harvard et de Andrew Fenton de l’Université de Sheffield, l'équipe de Christophe Grangeasse du laboratoire de Microbiologie moléculaire et biochimie structurale, a identifié un régulateur de l'activité d'une PBP chez la bactérie pathogène Streptococcus pneumoniae. Ces travaux publiés le 26 Février dans la revue PNAS laissent entrevoir de nouvelles possibilités pour bloquer le fonctionnement des PBPs et pour combattre les infections bactériennes.
Les PBPs sont des enzymes clés de l'assemblage du peptidoglycane, un polymère de sucre réticulé par des ponts peptidiques, qui entoure la cellule bactérienne et lui confère sa forme cellulaire ainsi que des propriétés de résistance mécanique et immunomodulatrices. Tout défaut dans la synthèse et l'assemblage de ce polymère est dramatique pour la survie de la cellule bactérienne. Ainsi, de nombreux antibiotiques actuellement utilisés pour traiter les infections bactériennes ciblent les PBPs afin de compromettre l'intégrité de ce polymère. Cependant, certaines bactéries développent des mutations au niveau de certaines PBPs réduisant leur affinité pour ces antibiotiques et leur conférant ainsi la capacité de résister aux antibiotiques de type beta-lactames. Ceci est tout particulièrement vraie pour la bactérie Streptococcus pneumoniae (le pneumocoque) dont la prévalence des souches multi-résistantes est particulièrement élevée.
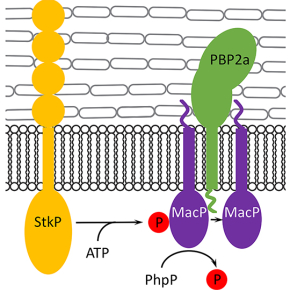
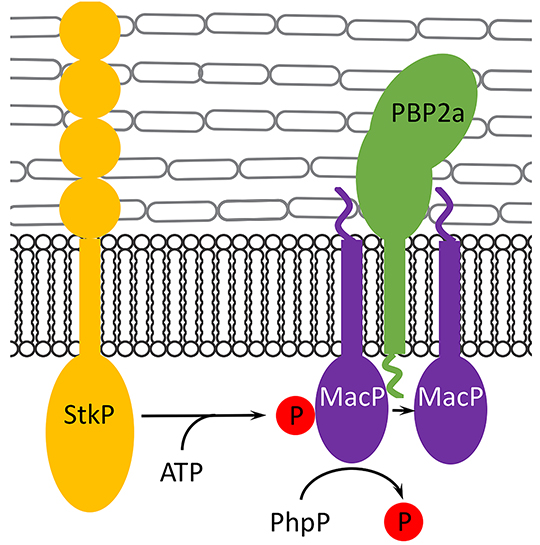
Le pneumocoque produit 6 PBPs différentes. Le rôle respectif de chacune d'entre elles dans l'assemblage du peptidoglycane, et donc l'acquisition de la forme particulière en ballon de rugby du pneumocoque, est encore mal compris. Néanmoins, plusieurs travaux suggèrent que certaines d'entre elles pourrait présenter une redondance fonctionnelle. C'est notamment le cas de PBP1a et PBP2a donc la délétion simultanée est létale pour le pneumocoque alors que la délétion individuelle est tout à fait tolérée. Dans ce travail, les chercheurs ont mis en évidence qu'une protéine de fonction inconnue, qu'ils ont appelé MacP, est essentielle pour la fonction PBP2a. En effet, le pneumocoque déficient pour PBP1a n'est pas capable de survivre en absence de MacP alors qu'un mutant déficient pour PBP2a et MacP se développe normalement.
Ils ont ensuite démontré que MacP est capable d'interagir directement avec PBP2a et que les deux protéines co-localisent au septum de division. De manière très intéressante, ces travaux ont également mis en évidence que MacP est phosphorylé par la serine/thréonine-kinase StkP qui est le régulateur central de la division cellulaire et la morphogénèse du pneumocoque. Les chercheurs ont alors observé que la phosphorylation n'était pas requise pour l'interaction de MacP avec PBP2a mais que la fonction de cette dernière était influencée par l'état de phosphorylation de MacP.
Ce travail a donc permis d'identifier un régulateur spécifique de PBP2a chez le pneumocoque dont la fonction est régulée par phosphorylation. A partir de là, il laisse entrevoir de nouvelles stratégies de lutte contre les infections dues à des pneumocoques résistants aux antibiotiques en développant des molécules ciblant un régulateur plutôt que la PBP elle-même.
© Christophe Grangeasse
En savoir plus
-
Phosphorylation-dependent activation of the cell wall synthase PBP2a in Streptococcus pneumoniae by MacP
Andrew K. Fenton, Sylvie Manuse, Josué Flores-Kim, Pierre Garcia, Chryslène Mercy, Christophe Grangeasse, Thomas G. Bernhardt and David Z. Rudner. PNAS published ahead of print Feb 27, 2018: https://doi.org/10.1073/pnas.1715218115