Une nouvelle technologie pour identifier le loquet d'une micro-arbalète bactérienne
Certaines bactéries ont développé une structure contractile, appelée système de sécrétion de type VI, qui fonctionne en tout point comme une arbalète capable de décocher une micro-flèche létale dans des bactéries cibles avec lesquelles elles sont en compétition pour l’accès aux ressources de l’environnement. Cette flèche est entourée d'un ressort, qui en se contractant, permet l'éjection de la flèche. Les chercheurs ont identifié, chez une souche pathogène d'Escherichia coli, l'élément qui permet d'arrêter la polymérisation de la flèche. Cette nouvelle protéine, appelée TagA, sert également de loquet pour maintenir le ressort sous tension. Cette étude a été publiée le 24 septembre 2018 dans la revue Nature Microbiology.
Dans l'environnement, les bactéries ne vivent pas seules et sont en contact permanent avec d'autres microorganismes. Elles sont capables d'échanger des informations et des molécules chimiques. Cependant, lorsque les ressources nutritionnelles deviennent limitées, les bactéries entrent en compétition afin d'éliminer les autres espèces et ainsi avoir un accès privilégié aux nutriments.
Certaines bactéries ont développé des équipements sophistiqués qui leur permettent d'éliminer des bactéries compétitrices et des amibes. Le mécanisme le plus fascinant est le système de sécrétion de type VI (SST6) qui peut être comparé à une micro-arbalète ou un micro-harpon. Le SST6 fonctionne par un mécanisme contractile: une flèche se terminant par une pointe est entourée par un fourreau agissant comme un ressort. La contraction du ressort propulse la flèche en direction de la cellule cible. La pénétration de la flèche dans cette cellule permet de la tuer en transperçant sa membrane et en délivrant des toxines. L'assemblage de la structure contractile est un mécanisme assez bien décrit, mais l'élément permettant d'arrêter la polymérisation de cette structure était inconnu. Les chercheurs ont adapté à la bactérie une technologie (APEX pour Ascorbate PeroXidase) permettant dans ce cas une modification par biotinylation des protéines localisées à proximité de l'extrémité distale de la structure contractile.
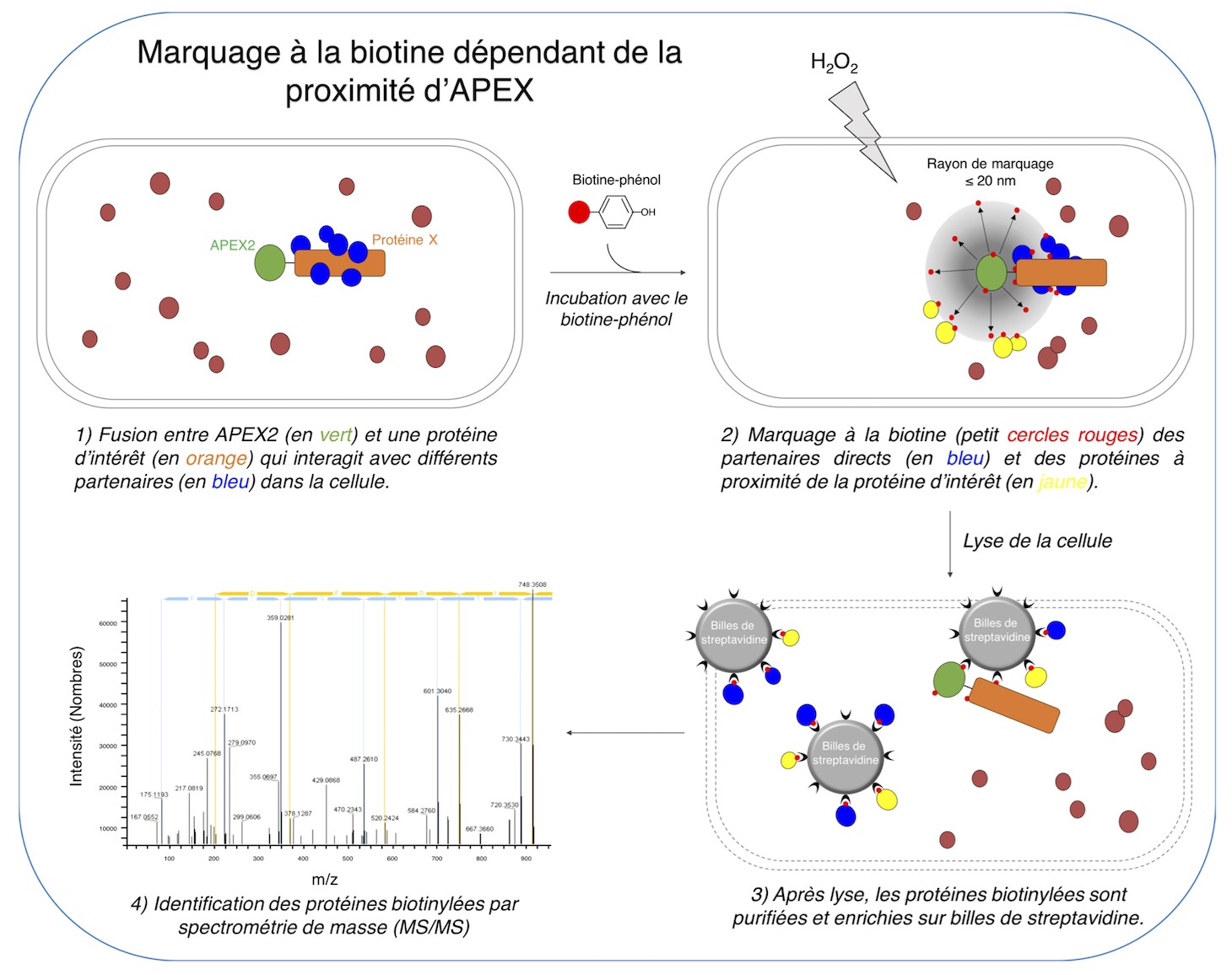
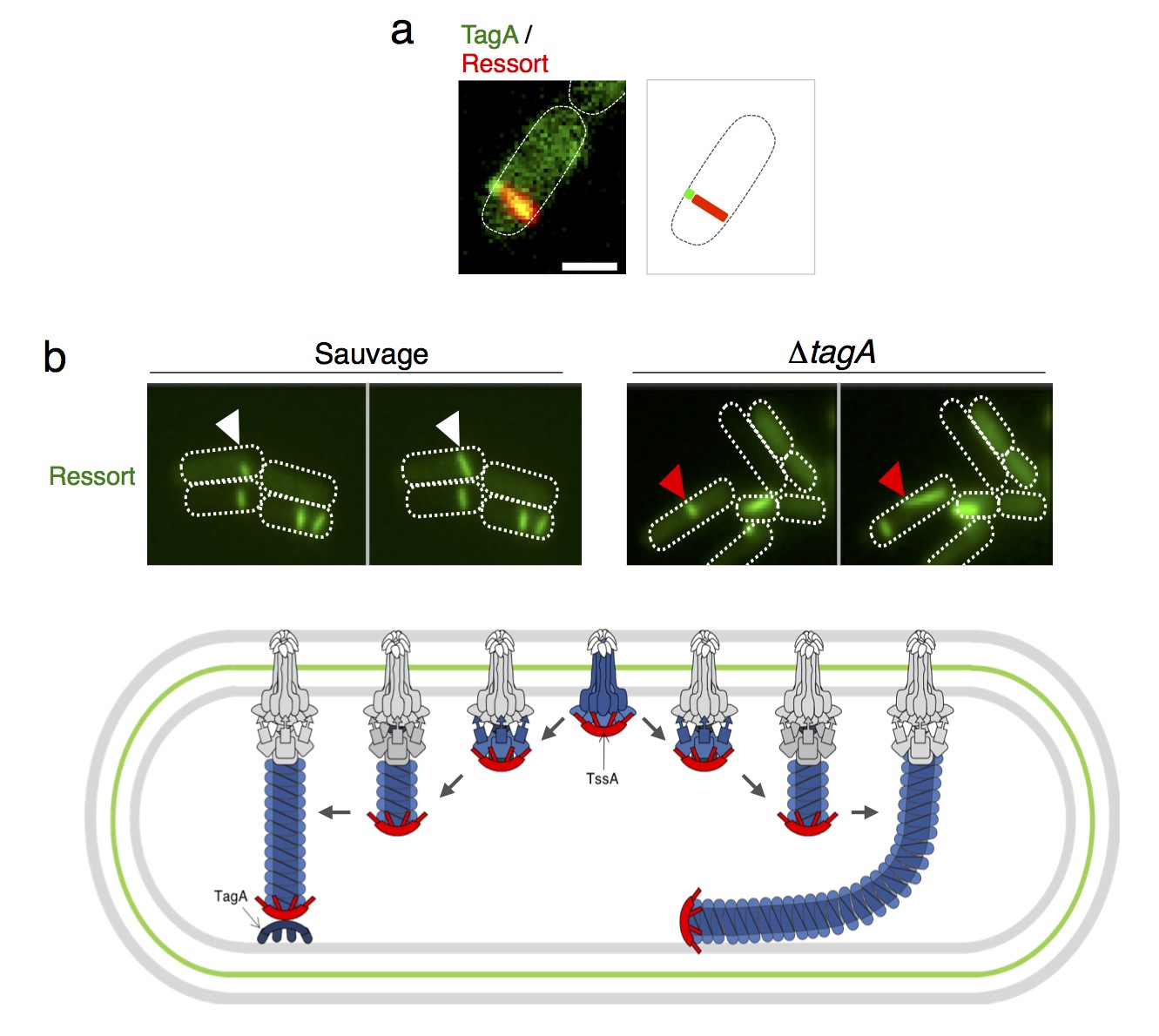
Ils ont ainsi identifié la protéine TagA qui permet d'arrêter l'assemblage de la flèche. En absence de TagA, la flèche continue sont assemblage, se déforme et finit par se casser. Des expériences supplémentaires permettant de mieux comprendre le mécanisme d'action de TagA ont également permis de révéler que TagA agit également comme un loquet qui permet de maintenir le ressort sous tension avant sa contraction (Figure 2).
© Yoann Santin
© Yoann Santin
En savoir plus :
In vivo TssA proximity labelling during type VI secretion biogenesis reveals TagA as a protein that stops and holds the sheath.
Santin YG, Doan T, Lebrun R, Espinosa L, Journet L, Cascales E.
Nat Microbiol. 2018 Oct 1. doi: 10.1038/s41564-018-0234-3. [Epub ahead of print]
