Comment produire au laboratoire les cellules dendritiques les plus efficaces contre le cancer ?
Les cellules dendritiques, chefs d’orchestre de l’immunité, sont des cibles prometteuses pour la vaccination ou l’immunothérapie. Leur utilisation médicale est toutefois limitée par l’incapacité à produire in vitro de grandes quantités des cellules dendritiques les meilleures pour activer les lymphocytes capables de tuer les cellules tumorales ou infectées. L’étude publiée dans la revue Cell Reports permet maintenant d’envisager utiliser ce type de cellules dendritiques comme vaccin contre le cancer, en particulier pour améliorer l’effet des inhibiteurs des points de contrôle immunitaire.
Les cellules dendritiques sont des globules blancs rares qui orchestrent nos défenses immunitaires contre les tumeurs ou les infections. En particulier, les cellules dendritiques contrôlent l'activation des lymphocytes T cytotoxiques qui sont des cellules tueuses capables de reconnaître et d'éliminer spécifiquement les cellules tumorales ou les cellules infectées par des virus. Les chercheurs ont mis au point des vaccins thérapeutiques exploitant l'efficacité unique des cellules dendritiques pour exercer cette fonction, afin de stimuler le système immunitaire des patients à éradiquer les virus ou les cancers. Une stratégie consiste à incuber les cellules dendritiques in vitro avec un adjuvant pour les activer correctement, combiné à des morceaux de virus ou de tumeurs qui leur permettront, une fois injectées aux patients, d'activer les lymphocytes T tueurs spécifiques de l'infection ou du cancer correspondant.
Cependant, il existe différents types de cellules dendritiques, et, malheureusement, celles qui sont les plus puissantes pour l'induction ou la réactivation de lymphocytes T tueurs dirigés contre des virus ou des tumeurs ne pouvaient pas être produites in vitro en quantités suffisantes pour les utiliser en médecine. Ce problème a participé à limiter l’efficacité des vaccinations par cellules dendritiques, dont les résultats sont très en deçà de ceux espérés. Pour faire sauter ce verrou, il était donc important de comprendre quels signaux sont nécessaires à une forte prolifération in vitro des cellules souches hématopoïétiques et à leur différentiation efficace dans le bon type de cellules dendritiques.
En testant systématiquement différentes combinaisons de facteurs de croissance et de cellules nourricières, les chercheurs ont établi une recette optimale pour la différenciation in vitro d'un nombre élevé de différents types cellules dendritiques humaines, y compris celles qui sont les meilleures pour l’activation des lymphocytes T tueurs. De plus, en combinant un certain nombre d'approches différentes, y compris l'expression de marqueurs de surface cellulaire, leurs réponses fonctionnelles aux adjuvants et leur programme global d'expression génique au niveau cellulaire unique, ils ont démontré que ces cellules dendritiques produites in vitro sont très similaires à celles directement isolées du sang périphérique de volontaires adultes humains sains. Cette étude a également permis de mieux comprendre le processus de différenciation de ces cellules dendritiques, y compris la découverte d'une voie de signalisation essentielle à leur développement.
Le protocole développé pour la production in vitro de différents types de cellules dendritiques humaines permettra de réaliser des criblages à grande échelle pour déterminer comment exploiter au mieux leurs fonctions spécifiques, en particulier pour l'induction ou la réactivation de lymphocytes T tueurs dirigés contre des virus ou des tumeurs. Par exemple, il sera possible de tester in vitro des banques de médicaments pharmacologiques ou de vecteurs d'inactivation de gènes pour déchiffrer systématiquement les voies moléculaires contrôlant la différenciation et les fonctions des différents types de cellules dendritiques humaines. Il sera aussi possible de tester systématiquement différentes combinaisons d'anticorps, d'adjuvants et d'antigènes, ainsi que leur formulation, afin d'identifier les vaccins candidats les plus puissants.
Les chercheurs ont montré que leur protocole fonctionne en utilisant les rares cellules souches hématopoïétiques qui peuvent être directement isolées du sang périphérique humain chez l’adulte. Par conséquent, une fois que ce protocole aura été adapté pour être conforme à une utilisation clinique, il pourrait permettre la génération d’un nombre élevé de cellules dendritiques à partir d’un petit prélèvement de sang de patient, dans des conditions permettant leur injection autologue en tant que vaccin thérapeutique pour stimuler la réactivation de lymphocytes tueurs ou même leur génération de novo chez les patients qui en sont dépourvus. La robustesse de cette étude est renforcée par des résultats similaires rapportés dans une étude indépendante menée parallèlement et publiée elle aussi récemment dans Cell Report (Kirkling et al., 2018).
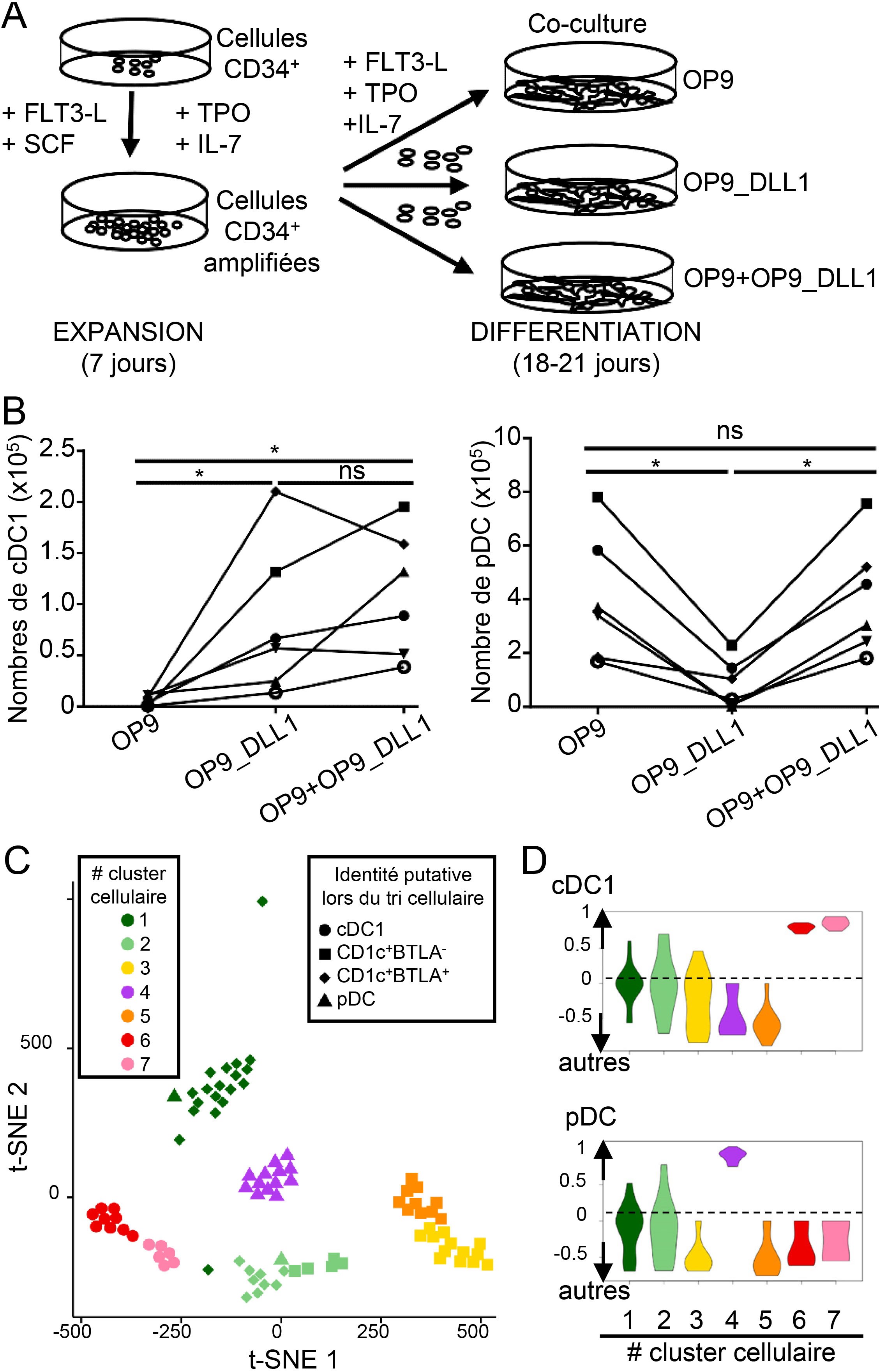
A) Schéma expérimental du protocole de culture cellulaire. Des cellules souches hématopoïétiques CD34+ sont amplifiées pendant 1 semaine en plaques de cultures en présence des facteurs de croissance/cytokines FLT3-L (Fms-related tyrosine kinase 3 ligand), SCF (stem cell factor) , TPO (thrombopoietin) et IL-7 (interleukin-7), puis repiquées sur une monocouche de cellules nourricières pour une phase de différentiation durant 2 à 3 semaines en présence de FLT3-L, TPO et IL-7. Trois types de cellules nourricières ont été comparés, des cellules stromales normales (OP9) ou manipulées génétiquement pour exprimer une molécule ligand activant la voie de signalisation du récepteur NOTCH dans les cellules souches hématopoïétiques (OP9_DLL1), et un mélange des deux (OP9+OP9_DLL1).
B) Enumération de différents types de cellules dendritiques à l’issu de la culture: les cellules dendritiques cDC1s, les plus efficaces pour l’activation des lymphocytes T tueurs, et les cellules dendritiques plasmacytoïdes (pDCs), les plus efficaces pour produire les cytokines antivirales appelées interférons de type 1. Seule la combinaison de cellules nourricières OP9+OP9_DLL1 permet d’obtenir à la fois un grand nombre de cDC1s et de pDCs, environ 300 000 cDC1s et 1 000 000 pDCs pour 10 000 cellules souches hématopoïétiques.
C-D) Analyse cellule par cellule de l’expression génétique des cellules obtenues en culture. Des cellules issues de la culture ont été triées individuellement sur la base de leur identité supposée, puis leur expression génétique a été évaluée par séquençage de l’ARN. C) Représentation de la proximité du programme d’expression génétique entre les différentes cellules triées. Toutes les cellules triées comme cDC1s putatives se regroupent ensemble dans deux clusters cellulaires représentés en ronds rouge ou rose. La majorité des cellules triées comme pDCs putatives se regroupent ensemble dans un cluster cellulaire représenté en triangles violets.
D) Une analyse d’enrichissement de signature génétiques préétablies à partir de types cellulaires isolés du sang périphérique de volontaires adultes sains permet de montrer que toutes les cellules des clusters rouge et rose expriment fortement les gènes définis comme spécifiques des cDC1s en comparaison avec toutes les autres cellules immunitaires examinées, tandis que toutes les cellules du cluster violet expriment fortement les gènes des pDCs.
© Marc Dalod
En savoir plus :
Large-Scale Human Dendritic Cell Differentiation Revealing Notch-Dependent Lineage Bifurcation and Heterogeneity.
Balan S, Arnold-Schrauf C, Abbas A, Couespel N, Savoret J, Imperatore F, Villani AC, Vu Manh TP, Bhardwaj N, Dalod M.
Cell Rep. 2018 Aug 14;24(7):1902-1915.e6. doi: 10.1016/j.celrep.2018.07.033.
