Genèse de la diversité neuronale olfactive: le poisson zèbre éclaire le débat
Chez les vertébrés, les organes sensoriels permettent aux animaux de percevoir les signaux émis par leur environnement. Le bon fonctionnement de ces organes nécessite le développement embryonnaire correct de nombreux types cellulaires. Ainsi, l’épithélium olfactif est composé de plusieurs populations neuronales dont l’origine embryonnaire fait débat. En utilisant des approches élégantes d’imagerie chez l’embryon de poisson zèbre, l’équipe de Patrick Blader au Centre de biologie du développement révèle que, contrairement à des résultats antérieurs, le territoire olfactif embryonnaire génère sa propre diversité neuronale. Cette étude a été publiée le 2 janvier 2018 dans la revue eLife.
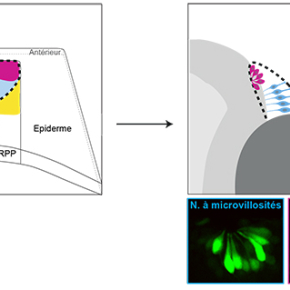
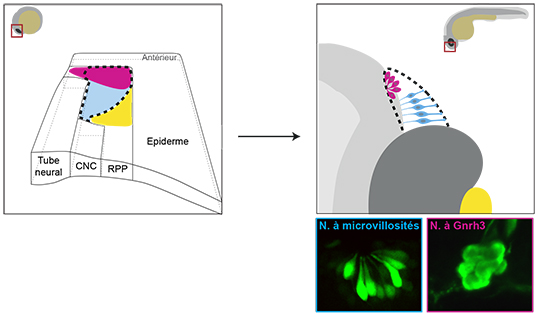
Chez les vertébrés, au cours du développement embryonnaire, l’organe sensoriel olfactif émerge à partir d’un territoire ectodermique (la région pré-placodale ou RPP) qui va générer les placodes olfactives puis l’épithélium olfactif. Ce dernier est constitué d’une variété de neurones dont l’origine embryonnaire fait débat. Ainsi, chez l’embryon de poisson zèbre, alors que les neurones sensoriels ciliés naissent dans l’ectoderme pré-placodal, d’autres expériences de lignage (servant à établir la généalogie ou l’origine de ces neurones) suggèrent que les neurones qui produisent l’hormone de libération des gonadotrophines hypophysaires (ou neurones à Gnrh3) dériveraient des crêtes neurales céphaliques (CNC). Il est important de noter que chez l’Homme, le syndrome de Kallmann (ou syndrome olfacto-génital) associe un hypogonadisme (via un déficit ou une absence de Gnrh) à un déficit de la perception des odeurs ou anosmie. Caractériser l’origine des neurones à Gnrh est crucial afin de mieux comprendre cette pathologie.
Les chercheurs révèlent que ces neurones à Gnrh3 proviendraient du domaine antérieur de la RPP. Ils ont tout d’abord identifié un nouveau marqueur des neurones à Gnrh3 qui est toujours présent dans des embryons qui ne possèdent plus de dérivés des crêtes neurales céphaliques (comme certaines populations de neurones périphériques), remettant d’autant en question l’origine CNC de ces neurones à Gnrh3. Grâce à l’utilisation d’une lignée transgénique permettant de marquer spécifiquement cette population neuronale, ils ont mis en évidence le territoire d’origine de ces neurones en utilisant une approche de microscopie sur embryon vivant et en temps réel. Ainsi, ils ont pu marquer précocement le domaine antérieur de la RPP (identifié comme territoire d’origine des Gnrh3) et montrer que ces cellules exprimaient tardivement un marqueur des neurones Gnrh3, confirmant ces résultats.
Des expériences similaires ont alors été réalisées avec une autre population neuronale, les neurones olfactifs sensoriels à microvillosités, dont l’origine CNC ne faisait pas consensus. Les résultats ont conduit à la même conclusion, i.e, il ne semble pas y avoir une contribution des CNC à l’épithélium olfactif.
En conclusion, la diversité neuronale au sein de l’épithélium olfactif semble être générée localement dans la partie antérieure de la RPP. Ces travaux permettent de lever une ambiguïté dans le domaine et renforcent le rôle de la région pré-placodale dans la genèse des neurones à Gnrh3. Tout en soulignant le manque de marqueurs précoces de ces populations neuronales qui représentent un vaste champ d’investigation, ils ouvrent de nouvelles pistes thérapeutiques pour les patients atteints du syndrome de Kallmann.
© Julie Batut. Raphaël Aguillon
En savoir plus
-
Aguillon R, Batut J, Subramanian A, Madelaine R, Dufourcq P, Schilling TF, Blader P.
Elife. 2018 Jan 2;7. pii: e32041. doi: 10.7554/eLife.32041.