La kinase cdk1-cycline A est le facteur déclencheur de la division cellulaire.
Lors du cycle cellulaire, l'entrée en division (mitose) nécessite une activation rapide de la protéine kinase cdk1-cycline B. En appliquant un modèle mathématique à la division d’ovocytes de xénope, les chercheurs ont montré que l’activation du complexe cdk1-cycline B met en jeu une cascade de phosphorylation aboutissant à l'activation de la phosphatase Cdc25. Cette dernière va déphosphoryler et activer cdk1-cycline B en induisant l’entrée en mitose.
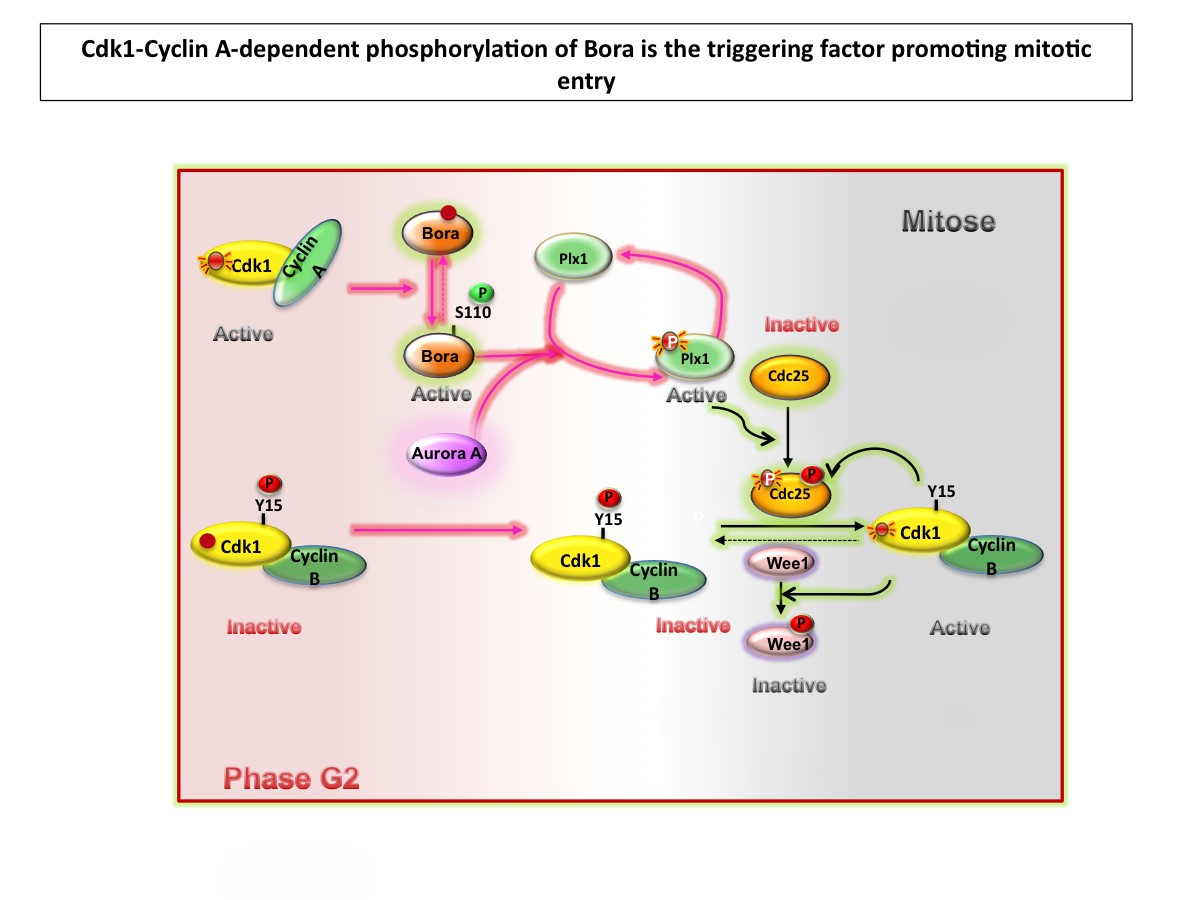
Le cycle cellulaire est sous le contrôle des kinases Cdk-Cycline dont l’activité oscille lors de chaque transition de ce cycle cellulaire. Au cours de la phase G2 (phase durant laquelle la duplication du génome est achevée mais la séparation des chromosomes-frères pas encore réalisée), la sous-unité régulatrice cycline B est progressivement synthétisée, et se lie alors à sa sous-unité catalytique cdk1. Ce complexe est immédiatement phosphorylé sur un site inhibiteur (tyrosine15 = Y15) par la kinase Wee1. Lors de l’entrée des cellules en mitose, la protéine phosphatase Cdc25 est en charge de la déphosphorylation de ce résidu.
Auparavant, le modèle proposait que l’étape régulatrice critique dans l’activation de la kinase cdk1-cycline B, requise pour l’entrée en mitose, repose sur la quantité de cycline B synthétisée et disponible pour former le complexe avec cdk1. Ainsi, lorsque la quantité de cycline B atteint un seuil limite, le complexe cdk1-cycline B déclenche une faible phosphorylation de la kinase Wee1 et de la phosphatase Cdc25 entrainant une boucle positive de rétro-contrôle.
Toutefois, comment expliquer qu’une primo activation de la kinase cdk1-cycline B puisse avoir lieu alors même que ce complexe est immédiatement inhibé, dès sa formation, par phosphorylation (Y15) ?
Cette question vient d’être élucidée dans le modèle des ovocytes de xénope. Dans cet article, publié dans la revue Development Cell, les chercheurs montrent que la kinase cdk1-cycline A est le vrai facteur déclencheur de l’entrée en mitose, plutôt que cdk1-cycline B.
Cette découverte a été possible grâce à une double observation. La première indique que la kinase cdk1-cycline A est un mauvais substrat de Wee1 suggérant qu’une fois formée, cette kinase échappe à l’inhibition par phosphorylation et devient active. La deuxième observation montre que l’activation de la kinase cdk1-cycline A précède celle de la kinase Plx1. Cette kinase, qui phosphoryle et active la phosphatase Cdc25, fait partie intégrante de la boucle de rétro-contrôle positive qui permet l’activation de cdk1-cycline B.
Il restait à comprendre comment cette kinase cdk1-cycline A activait Plx1.
Partant de l'observation que le complexe cdk1-cycline A est incapable de phosphoryler directement cette kinase, les chercheurs ont analysé les protéines Aurora A et Bora, déjà impliquées dans l’activation de Plx1. De façon intéressante, leurs résultats révèlent que cdk1-cycline A phosphoryle Bora, puis la kinase Aurora A, certainement associée à Bora favorise l'activation de Plx1 par phosphorylation.
L’élimination de la protéine Bora dans les extraits cytoplasmiques d’œufs de Xénope empêche l’activation de Plx1, de cdk1-cycline B et l’entrée en mitose. Toutefois, l’ajout d’une protéine Bora exogène (non phosphorylée) dans ces mêmes extraits dépourvus de Bora, permet de sauver ce phénotype, mais cet ajout ne permet pas de sauver un extrait dépourvu, en plus, de Cycline A. Si la protéine Bora rajoutée aux extraits cytoplasmiques est préalablement phosphorylée par cdk1-cycline A, cela provoque l’activation de Plx1 puis de cdk1-cycline B et induit l’entrée en mitose.
L’ensemble de ces résultats met en évidence l'importance du complexe cdk1-cycline A lors de la transition G2-mitose. Le complexe cdk1-cycline A joue alors le rôle de commutateur mitotique en phosphorylant directement Bora et permettant ainsi l’activation de la kinase Plx1. En s'appuyant sur un modèle mathématique basé sur des équations différentielles, les chercheurs ont démontré que les niveaux d’activation de Plx1 définissent le seuil de cycline B totale requise pour l’entrée en mitose et établissent donc la durée de la phase G2.
© Thierry Lorca
En savoir plus :
Cyclin A-cdk1-Dependent Phosphorylation of Bora Is the Triggering Factor Promoting Mitotic Entry.
Vigneron S, Sundermann L, Labbé JC, Pintard L, Radulescu O, Castro A, Lorca T.
Dev Cell. 2018 Jun 4;45(5):637-650.e7. doi: 10.1016/j.devcel.2018.05.005.
