Un oscillateur biochimique pour réguler le moteur de la morphogenèse tissulaire
La morphogenèse tissulaire est conduite par des forces biomécaniques générées par des moteurs moléculaires tels que la myosine. Grâce à l'imagerie cellulaire, à la modélisation mathématique et à l'optogénétique, les chercheurs du Centre de Biologie Intégrative de Toulouse montrent qu'un oscillateur biochimique contrôle la contractilité pulsatile de la myosine pour réguler l'allongement du follicule ovarien chez la drosophile. Ce travail a été publié le 23 mars 2018 dans la revue Nature Communications.
Comprendre les mécanismes qui régissent la formation des tissus et des organes est un enjeu fondamental en biologie. Les réseaux d'actomyosine jouent un rôle crucial dans la morphogenèse tissulaire. La contractilité de la myosine, souvent en mode oscillatoire, a été observée dans de nombreux processus de morphogenèse. En ce qui concerne le follicule ovarien de la drosophile, dont le développement conduit à l’œuf de la drosophile, l’oscillation de la myosine au niveau basal des cellules folliculaires contrôle l'allongement du follicule ovarien, dont la forme sphérique devient ovoïde au fur et à mesure de sa croissance. Bien qu'une grande partie de la cascade de signaux régulant l'activité de la myosine ait été caractérisée, l'origine d'un tel comportement oscillatoire n'est toujours pas clair.
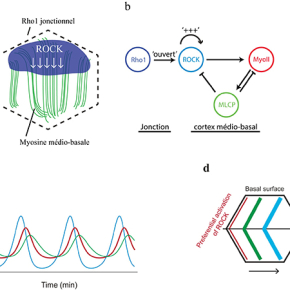
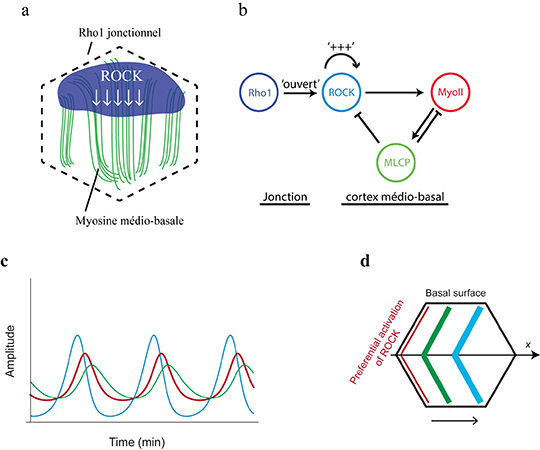
En prenant comme modèle d’étude l’ovaire de drosophile, les chercheurs ont exploré le mécanisme de contrôle de l'oscillation basale de la myosine. Ils montrent que l'oscillation de la myosine basale n'est pas contrôlée par la tension corticale de l'actomyosine, mais repose plutôt sur un oscillateur biochimique impliquant la kinase ROCK et la phosphatase MLCP, qui respectivement phosphoryle ou déphosphoryle la myosine. La clé de cette oscillation est un flux diffusif de ROCK, qui relie Rho1, son activateur en amont localisé au niveau des jonctions membranaires, et le cortex d’actomyosine, sa cible en aval situé à l’intérieur de la cellule. Ce flux est maintenu dynamiquement par une boucle d'auto-activation dépendante de l'activité kinase de ROCK. En réponse au recrutement de la myosine, MLCP est enrichie localement et arrête les signaux de ROCK et de la myosine (Figure 1a, b).
Tous ces résultats ont été obtenus en couplant la génétique de la drosophile, l'imagerie de tissus vivants, la modélisation et l'optogénétique. L'équipe de Xiaobo Wang a collaboré avec le Dr. Edouard Hannezo (IST, Autriche) pour modéliser mathématiquement l’évolution dans le temps de ROCK, de la myosine et de MLCP afin de simuler et d'expliquer les caractéristiques oscillatoires, le déphasage et l’onde de diffusion biochimique (Figure 1c, d). Afin d’explorer directement la dynamique spatio-temporelle de l'oscillateur biochimique, ils ont utilisé in vivo la technique GFP-LARIAT pour inhiber spatialement et temporellement la fonction de ROCK et de MLCP, confirmant ainsi l'oscillateur biochimique par optogénétique.
Ce travail démontre pour la première fois comment un oscillateur biochimique est formé pour générer la force nécessaire au changement de forme des tissus.
© Xiaobo Wang et Jiaying Liu
En savoir plus
-
A biochemical network controlling basal myosin oscillation.
Qin X, Hannezo E, Mangeat T, Liu C, Majumder P, Liu J, Choesmel-Cadamuro V, McDonald JA, Liu Y, Yi B, Wang X.
Nat Commun. 2018 Mar 23;9(1):1210. doi: 10.1038/s41467-018-03574-5.