Deux nouveaux inhibiteurs de phosphatase contrôlent la division cellulaire
La division cellulaire est induite par des phosphorylations séquentielles de protéines qui permettent la progression du cycle cellulaire. Ces phosphorylations résultent d'un réglage précis d'équilibres entre les activités des kinases et phosphatases. Afin d’étudier cet équilibre et son impact dans le contrôle du cycle cellulaire, les chercheurs ont utilisé des souris knock-out pour deux nouveaux inhibiteurs de la phosphatase PP2A. Dans une étude publiée dans la revue « Journal of Cell Biology » ils ont pu démontrer que ces deux inhibiteurs participent de façon différentielle au contrôle précis des différentes phases du cycle cellulaire.
La division cellulaire somatique ou mitose est un processus biologique fondamental essentiel au développement d'organismes multicellulaires et au maintien de l'homéostasie des tissus. Au cours du cycle, le génome doit être entièrement répliqué une seule fois au cours de la phase S. Dans la phase M suivante, le génome répliqué doit être séparé avec précision entre les cellules filles pour maintenir leur contenu génétique intact. D'un point de vue moléculaire, les transitions du cycle cellulaire sont contrôlées par des vagues de phosphorylations et déphosphorylations des protéines résultant d’activations et inhibitions séquentielles de kinases et phosphatases spécifiques.
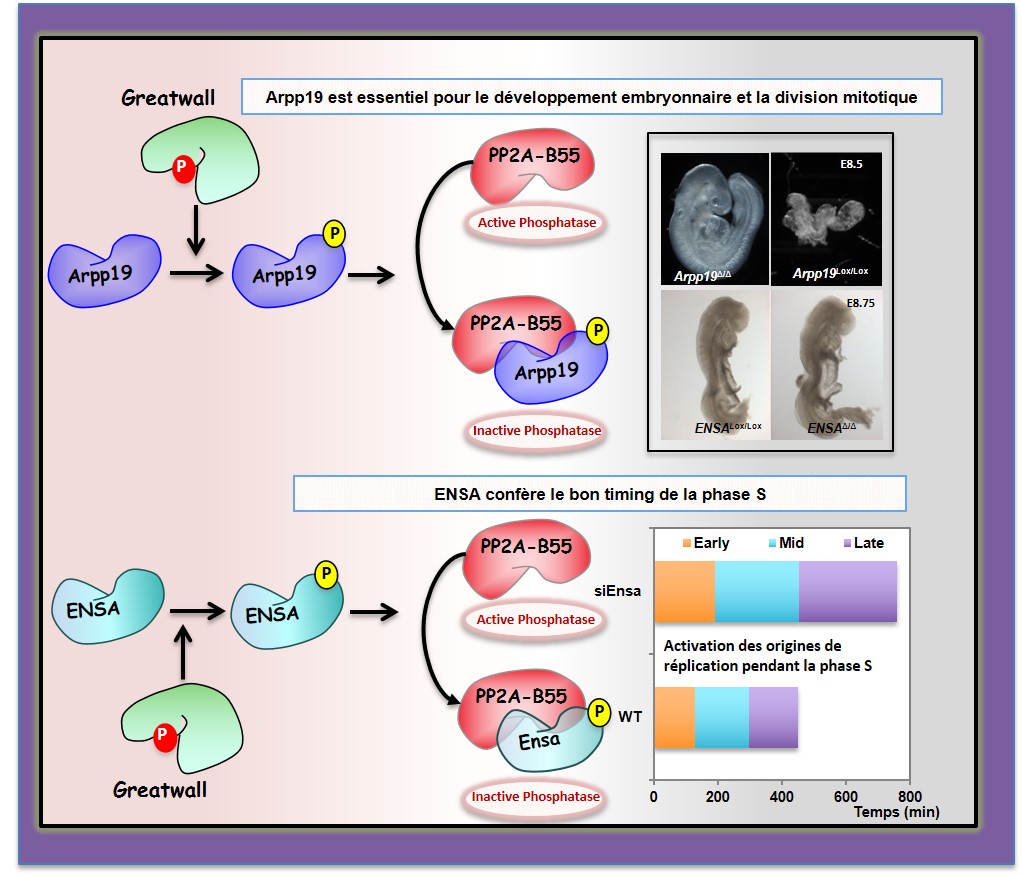
Ainsi, pendant la mitose, l’activation de la protéine kinase Cdk1-cycline B permet la phosphorylation de nombreuses protéines qui assurent le bon déroulement des différents évènements mitotiques. Ces phosphorylations permettent la rupture de l’enveloppe nucléaire, la condensation adéquate des chromosomes et la formation du fuseau mitotique. Afin de maintenir un niveau correct de ces phosphorylations, l’activité de la phosphatase PP2A-B55 en charge de la déphosphorylation de ces substrats est maintenue inhibée grâce à la protéine kinase Greatwall. Greatwall n’inhibe pas directement PP2A-B55 mais phosphoryle deux petites protéines appelées Arpp19 et ENSA qui une fois phosphorylées s’associent et inhibent l’activité de PP2A-B55 (Figure). Bien que, in vitro, ces deux protéines puissent inhiber de la même manière l’activité de la phosphatase, il a été rapidement proposé que seule ENSA pouvait assurer l’inhibition de cette phosphatase lors de la division cellulaire. Cela s’expliquant par la difficulté à détecter Arpp19 au niveau cellulaire à cause de sa faible expression. Toutefois, les premiers travaux réalisés par les chercheurs du CRBM pour comprendre comment Greatwall régulait PP2A-B55 avaient permis d’identifier Arpp19 comme principal substrat de Greatwall et inhibiteur de PP2A-B55. La question du rôle spécifique de chacun de ces deux substrats était par conséquent une question qui demeurait donc ouverte.
Afin de définir le rôle spécifique de chacune de ces deux protéines les chercheurs ont construit des knockouts (KO) chez la souris pour chacune des deux protéines. Les résultats montrent que la protéine Arpp19 est essentielle pour le développement de l’embryon de souris. En effet, l’absence de Arpp19 est létale pour l’embryon. A l’inverse l’absence de la protéine ENSA n’affecte pas le développement embryonnaire, au moins jusqu’au stade E8.5.
A partir des embryons dépourvus de la protéine Arpp19, les chercheurs ont purifié des cellules embryonnaires. Cela a permis de montrer que l’absence de Arpp19 induit l’activation rapide de la phosphatase PP2A-B55 entrainant une déphosphorylation prématurée de nombreuses protéines mitotiques, ce qui s’accompagne de nombreuses catastrophes mitotiques (Vidéo). Parmi ces protéines, on retrouve des acteurs majeurs des étapes de la mitose (condensation des chromosomes, transition métaphase-anaphase et séparation des homologues, reformation de l’enveloppe nucléaire, séparation des cytoplasmes-cytocinèse).
Ces cellules sans Arpp19 meurent rapidement. Les résultats antérieurs du même laboratoire suggérant que la protéine ENSA joue un rôle important lors de la phase S ont été confirmés dans cette étude qui montre que la protéine Arpp19, elle, n’intervient pas à ce stade du cycle cellulaire. Ensemble, ces résultats mettent en évidence une spécificité fonctionnelle de ces deux substrats et révèlent une régulation très fine de la phosphorylation protéique lors du cycle cellulaire par la protéine kinase Greatwall.
© Anna Castro
vidéo
Vidéo : Vidéo de fibroblastes embryonnaires de souris KO pour le gène Arpp19 obtenue par imagerie confocale. L’ADN est marqué en rouge par microscopie de fluorescence (H2B-CherryFP) alors que la position des cellules est visualisée en gris par microscopie à contraste interférentiel. Cette image représente un exemple des différentes anomalies mitotiques présentes dans les cellules dépourvues d’Arpp19. Une des cellules exhibe une chromatine condensée en prométaphase qui est rapidement décondensée avant qu’il y ait la ségrégation des chromosomes. Cela donne lieu à une cellule aneuploïde avec des micronuclei.
© Anna Castro
Audiodescription
En savoir plus
-
ENSA and ARPP19 differentially control cell cycle progression and development.
Hached K, Goguet P, Charrasse S, Vigneron S, Sacristan MP, Lorca T, Castro A.
J Cell Biol. 2019 Jan 9. pii: jcb.201708105. doi: 10.1083/jcb.201708105