Virus de l’hépatite C : une maturation originale des particules virales à l’extérieur de leur cellules productrices
Les chercheurs viennent de mettre au point une nouvelle méthode de production du virus permettant de produire in vitro des particules avec les mêmes propriétés que celles retrouvées chez les patients. Grâce à cette méthode, ils ont identifié comment les particules de ce virus à la composition unique devenaient matures et comment cela impacte son infectiosité et sa résistance aux anticorps. Ces résultats sont publiés dans Journal of Hepatology.
L’infection par le virus de l’hépatite C (VHC) est un problème de santé publique majeur, causant des milliers de mort chaque année. Des antiviraux sont maintenant capables de guérir cette infection mais le diagnostic et l’accès à ces traitements couteux restent limités.
La recherche d’un vaccin est un enjeu crucial pour éradiquer ce virus, mais reste compliquée de par les mécanismes déployés par le VHC pour échapper à la réponse immune et notamment aux anticorps neutralisants qu’il induit. En effet, les particules du VHC ont la caractéristique unique de s’associer avec les lipoprotéines, les particules de transport des lipides dans l’organisme, leur permettant de prendre leur apparence et ainsi de se cacher dans le sérum des patients. Plus précisément, cela permet au virus d’échapper au moins partiellement à la réponse immunitaire et d’établir des infections chroniques qui peuvent conduire au développement de cirrhoses et d’hépato-carcinomes. Dans ce contexte, la mise au point d’un vaccin est difficile car il existe peu de modèles de production de VHC in vitro permettant de parfaitement mimer la conformation et la structure des particules telles que l’on les retrouve chez les patients.
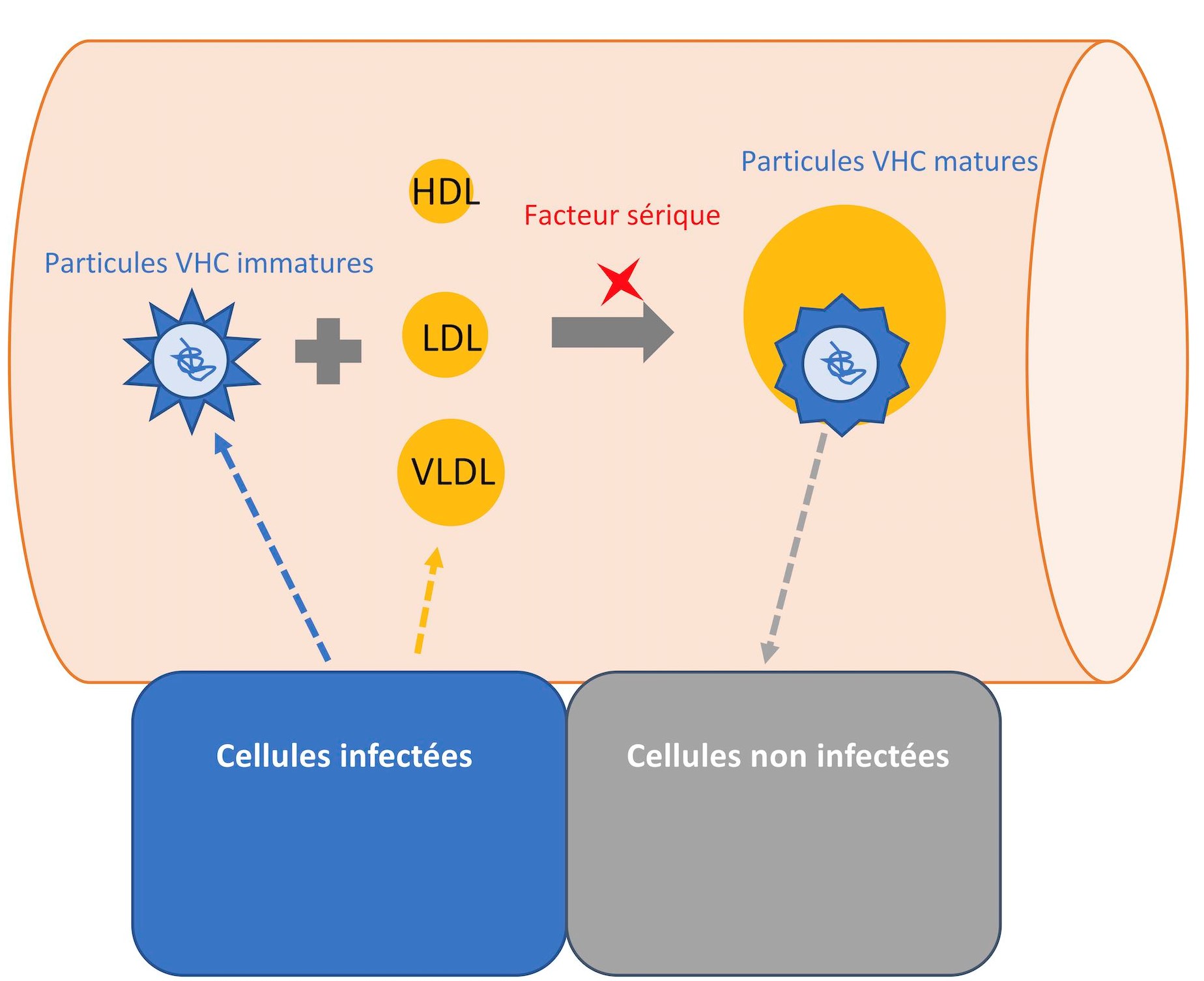
Les chercheurs ont mis au point une nouvelle méthode de production in vitro de particules du VHC permettant d’obtenir des particules ressemblant en tout point à celles retrouvées chez les patients infectés en termes d’association aux lipides neutres et à apoB (qui sont les composants principaux des lipoprotéines). En utilisant cette méthode, l’équipe a pu mettre en évidence les mécanismes d’association de la particule avec les lipides neutres. D’une part, elle a pu montrer que les particules virales sont capables de s’associer avec ces lipides dans le milieu extracellulaire, après que les virions soient sécrétés en dehors de leurs cellules productrices. D’autre part, elle a pu identifier les sources de lipides ainsi que les régulateurs viraux de cette association. En particulier, les virions utilisent comme source de lipides les différentes classes de lipoprotéines du sérum : les lipoprotéines de très basses densités (VLDL), de basses densités (LDL) et de hautes densités (HDL). Cette étude révèle que l’association des particules du VHC peut se faire avec chaque classe de lipoprotéines, mais nécessite l’intervention d’autres facteurs protéiques du sérum, notamment l’albumine. Les chercheurs ont également pu montrer que le degré d’association de la particule virale avec ces lipoprotéines est régulé par une petite région de la glycoprotéine E2 du VHC, appelée région hypervariable I (HVRI). Enfin, ils montrent que cette lipidation des particules virales augmente leur infectiosité et leur résistance aux anticorps neutralisants.
Cette étude a ainsi permis de mieux comprendre le mécanisme mis en place par le VHC pour se cacher du système immunitaire et ainsi induire une infection chronique chez les patients. Elle devrait permettre de mieux caractériser la structure et les mécanismes d’entrée cellulaire de particules virales ressemblant très fortement à celles trouvées chez les patients mais aussi de découvrir des épitopes neutralisants qui restent potentiellement accessibles, dans une perspective de développement vaccinal.
© Solène Denolly
En savoir plus
-
A serum protein factor mediates maturation and apoB-association of HCV particles in the extracellular milieu.
Denolly S, Granier C, Fontaine N, Pozzetto B, Bourlet T, Guérin M, Cosset FL.
J Hepatol. 2018 Dec 13. pii: S0168-8278(18)32619-9. doi: 10.1016/j.jhep.2018.11.033. [Epub ahead of print]
