Comment les toxines de venin de scorpion nous renseignent-elles sur l’inactivation rapide des canaux sodium?
Comment comprendre une des propriétés fondamentales des canaux sodium activés par le voltage à savoir leur l’inactivation rapide après ouverture ? Une étude internationale incluant la société californienne Genentech Inc., les universités d’Oxford, Iowa, Johns Hopkins, Ghent, Aix-Marseille et le CNRS a permis d’en proposer un mécanisme moléculaire en comparant les structures tridimensionnelles obtenues par Cryo-EM d’une forme apo d’un canal sodium et son complexe avec une toxine alpha de venin de scorpion.
Les canaux sodium activés par le voltage et situés dans la membrane de nos cellules excitables s’ouvrent en fonction d’une variation du potentiel membranaire (dépolarisation) pour laisser passer des ions sodium. Ils participent ainsi à l’initiation et à la propagation des influx nerveux. Ce rôle primordial leur confère une implication majeure dans certaines mutations pathogéniques, en tant que cible préférentielle de diverses toxines, et de médicaments. Si ces canaux sodium doivent largement s’ouvrir pour remplir pleinement leur rôle, leur inactivation (fermeture) se doit d’être particulièrement efficace et rapide (millisecondes) pour leur permettre d’être de nouveau fonctionnellement disponibles. Cette étape essentielle était à ce jour encore mal appréhendée au plan fonctionnel et les résultats de cette étude y contribuent aujourd’hui.
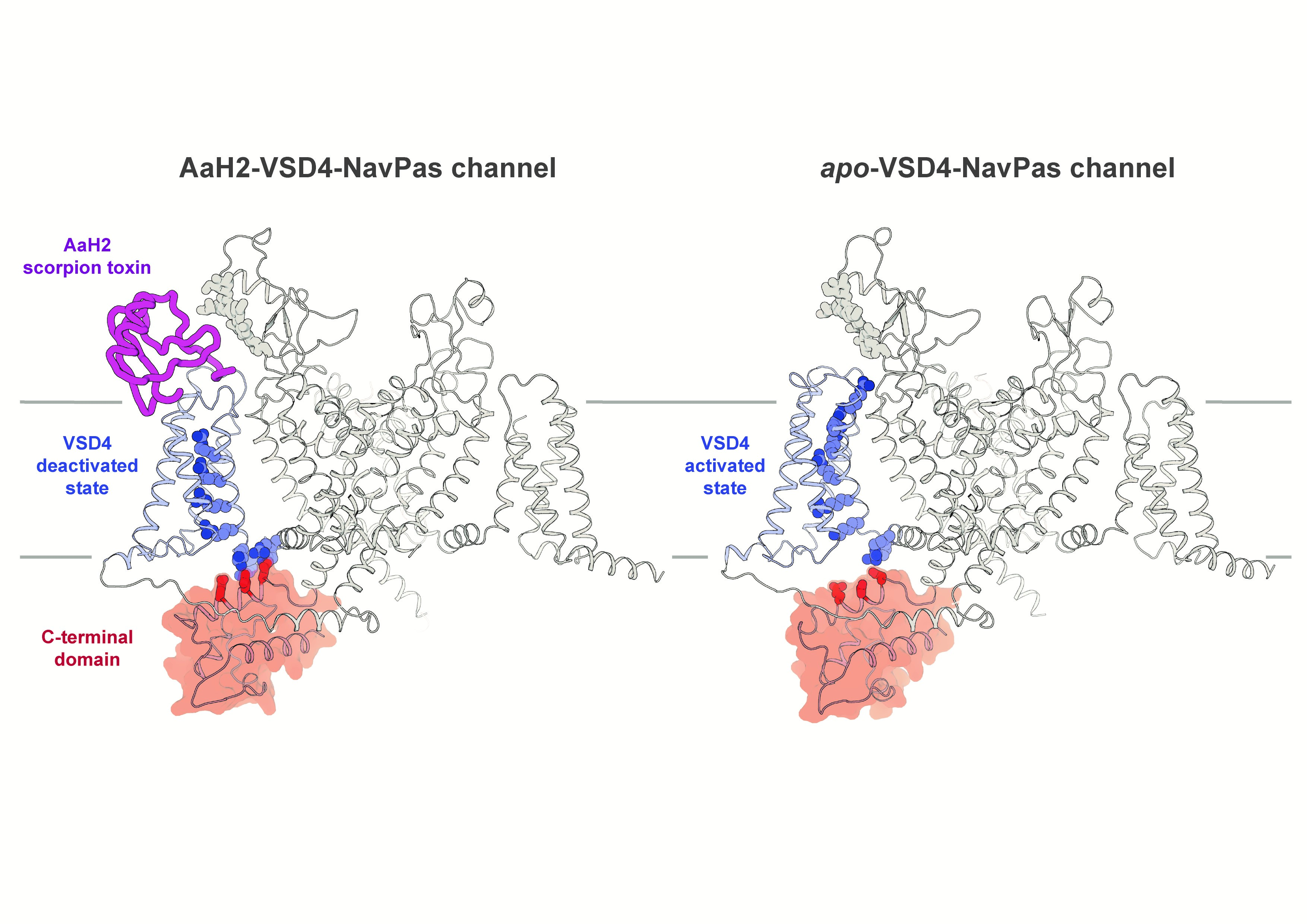
La toxine alpha (AaH2) du scorpion Androctonus australis (littéralement tueur d’hommes) est connue pour se fixer avec une grande affinité sur un des quatre senseurs de voltage (VSD) des canaux sodium, le VSD4, qui est directement impliqué dans l’inactivation rapide du canal. Grâce à la nouvelle technique d’étude structurale basée sur la microscopie électronique cryogénique à très haute résolution (Cryo-EM) les chercheurs ont pu obtenir une image tridimensionnelle précise d’un complexe toxine alpha-canal sodium (voir figure). La comparaison avec le canal dépourvu du ligand (apo) permet pour la première fois de poser les bases mécanistiques de l’inactivation rapide. AaH2 piège le senseur de volage VSD4 dans un état désactivé, révélant une interface non anticipée. Des charges positives du senseur de voltage VSD4 peuvent se coupler électrostatiquement via des résidus acides non seulement au domaine C-terminal du canal (CTD), mais aussi au segment intracellulaire connectant les domaines III et IV du canal, tous deux se révélant ainsi impliqués dans le processus d’inactivation rapide.
Ces résultats proposent un cadre structural qui met en lumière le fonctionnement distinctif particulièrement spécialisé du VSD4. Cette étude fournit des bases permettant de mieux interpréter la détection des variations du voltage, de son couplage électromécanique à l’inactivation rapide des canaux sodium et leur lien avec certaines mutations pathogènes notoires aboutissant à des états épileptiques.
Mieux comprendre les bases moléculaires du fonctionnent des canaux sodium activé par le voltage, notamment ceux impliqués dans les fonctions neuronales, musculaires et cardiaques, ou somatosensorielles (toucher/douleur), est un prérequis pour la recherche d’une meilleure pharmacologie corrective des pathologies liées à leur dysfonctionnement.
© Thomas Clairfeuille
En savoir plus
-
Structural basis of α-scorpion toxin action on Nav channels.
Clairfeuille T, Cloake A, Infield DT, Llongueras JP, Arthur CP, Li ZR, Jian Y, Martin-Eauclaire MF, Bougis PE, Ciferri C, Ahern CA, Bosmans F, Hackos DH, Rohou A, Payandeh J.
Science. 2019 Feb 7. pii: eaav8573. doi: 10.1126/science.aav8573
