Voyage au centre du pore nucléaire
Le complexe de pore nucléaire régule les entrées et sorties des macromolécules dans le noyau cellulaire. Cette machinerie de transport doit permettre un débit très important en même temps qu'elle sélectionne efficacement les macromolécules passant d'un compartiment à l'autre. Cette étude parue dans la revue Nature communications révèle le trajet suivi par des particules macromoléculaires dans ce tunnel aux dimensions nanométriques grâce à la microscopie électronique en trois dimensions.
Chez les organismes eucaryotes, l'existence de compartiments intracellulaires délimités par des membranes va de pair avec des mécanismes de transport efficaces et sélectifs. Ainsi, entre le noyau et le cytoplasme, les macromolécules (protéines, ARN) doivent emprunter un des nombreux complexes de pore nucléaire (CPN) qui traversent l'enveloppe nucléaire. Seules les macromolécules portant les signaux adéquats peuvent franchir cette barrière sélective dans un sens ou dans l'autre. Les mécanismes assurant à la fois la sélectivité et le débit élevé de ce trafic bidirectionnel sont très débattus. Des progrès importants dans la résolution de la structure des CPN à l'échelle moléculaire suggèrent que plusieurs voies de transport pourraient exister. Pour comprendre le fonctionnement des CPN, il est nécessaire de déterminer le ou les chemins suivis par les macromolécules qui les empruntent.
Dans ce but, les chercheurs ont figé les molécules en transit dans les CPN dans des levures en quelques millisecondes grâce à la congélation ultra-rapide. Les cellules ont ensuite été observées par tomographie électronique, une technique qui fournit une image des structures cellulaires en trois dimensions à l'échelle du nanomètre. Dans une fraction des CPN observés, ils ont détecté des particules globulaires d'environ 20 nm de diamètre correspondant à des sous-unités ribosomiques en formation. Ces particules, formées d'ARN et de protéines, sont synthétisées en abondance dans le noyau et exportées dans le cytoplasme où elles participeront à la traduction des protéines. La cartographie des positions occupées par ces particules a permis d'établir qu'elles s'engagent dans le transporteur central, une structure précédemment définie par des études structurales et dont le diamètre est à peine supérieur à celui des sous-unités ribosomiques. Lorsqu'elles sont empêchées de s'associer avec l'exportine CRM1, une protéine qui agit sur le CPN comme un laisser-passer, les particules ribosomiques peuvent pénétrer en partie dans le CPN, mais s'accumulent à l'entrée du transporteur central, ce qui permet de positionner de manière précise la barrière de sélection. Pour estimer le temps moyen de transport dans le CPN, le trafic des sous-unités ribosomiques a été modélisé suivant une approche mathématique couramment utilisée pour analyser les flux dans les télécommunications, les transports, le système de santé… Appliquée aux images de tomographie, cette modélisation fait apparaître que chaque sous-unité ribosomique passe du noyau au cytoplasme en 90 ms en moyenne.
Couplée à la congélation ultra-rapide, la tomographie électronique a donc permis de déterminer le trajet de macromolécules dans le CPN à l'échelle du nanomètre tout en fournissant des informations sur leur temps de transport. De plus, ce travail montre qu'il est possible d'observer les sous-unités ribosomiques en transit dans le CPN dans des conditions "natives", sans qu'il soit besoin de les modifier artificiellement pour les rendre visibles en microscopie. Ces résultats ouvrent la voie à de futures études visant à préciser les différentes étapes du transport entre noyau et cytoplasme et à mieux comprendre les mécanismes régissant la sélectivité du CPN.
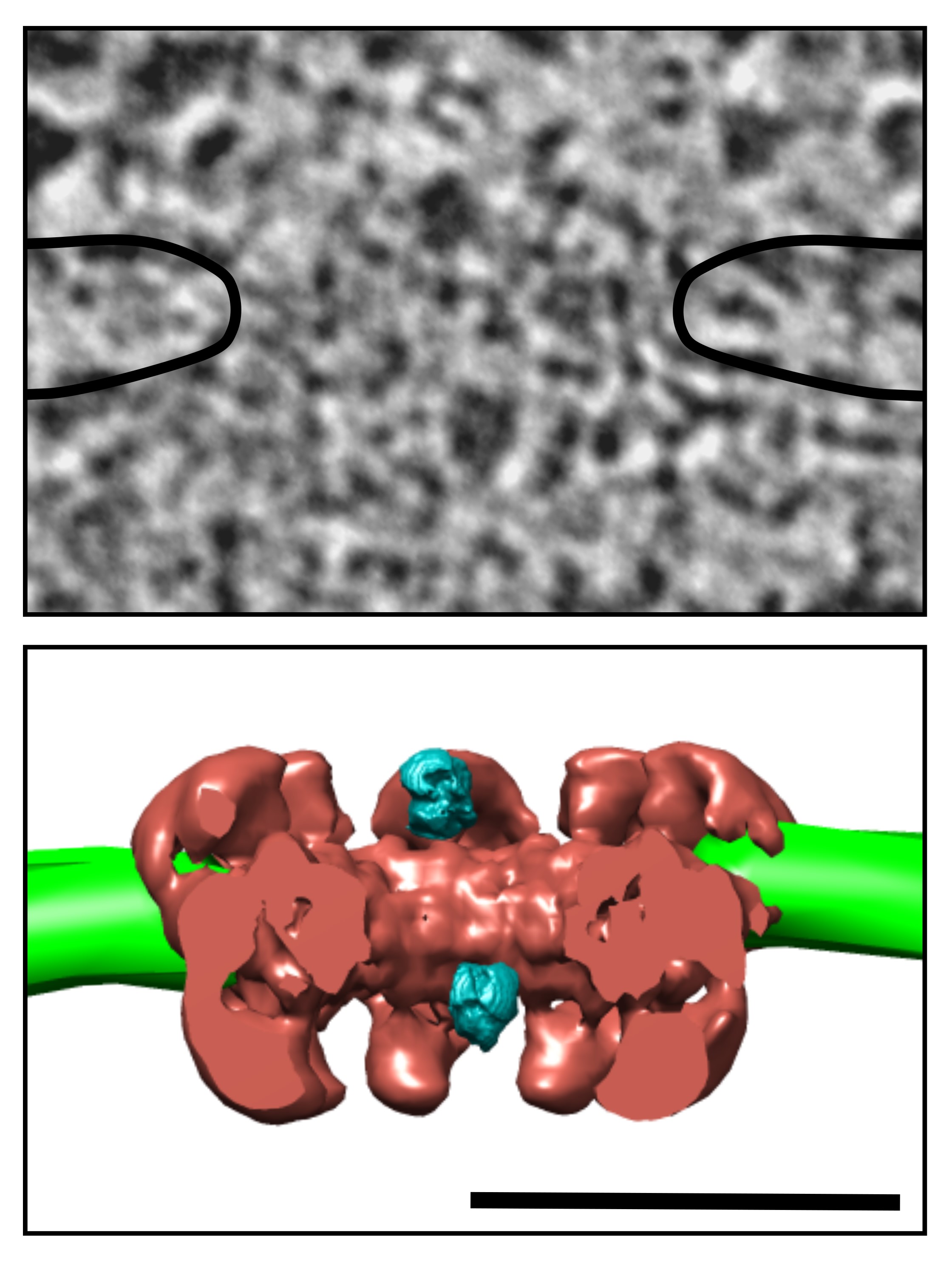
© Pierre-Emmanuel Gleizes & Franck Delavoie / CC by 4.0
En savoir plus
- The path of pre-ribosomes through the nuclear pore complex revealed by electron tomography. Delavoie F, Soldan V, Rinaldi D, Dauxois JY, Gleizes PE. Nat. Communications. 2019 10:497. doi: 10.1038/s41467-019-08342-7
