Les liens entre l’architecture 3D du génome et la construction du cerveau décodés
L'équipe de Giacomo Cavalli à l'Institut de génétique humaine, a généré des cartes en trois dimensions à ultra-haute résolution des contacts au sein de la chromatine in vivo à partir de cellules de cerveau de souris. Ceci montre que l'architecture tridimensionnelle du génome subit des changements à de multiples échelles pendant le développement. De nombreux contacts dynamiques associés aux facteurs de transcription, au processus d'épissage de l’ARN et à la régulation épigénétique sont ainsi révélés. Cette étude publiée le 19 octobre 2017 dans la revue Cell, illustre comment l'organisation spatiale du génome est profondément liée à sa fonction.
La façon dont le génome est organisé en 3D est apparue récemment comme intimement liée à sa fonction biologique et constitue un nouvel aspect passionnant du domaine de l’épigénétique, cette branche de la biologie qui étudie l’information héritable au-delà de la séquence de l’ADN. Les changements dans l'architecture du noyau cellulaire peuvent modifier le devenir cellulaire et des perturbations dans cette architecture peuvent entraîner des phénomènes pathologiques. Des interactions régulatrices entre des régions spécifiques déterminent si les gènes impliqués seront activés ou réprimés et sont donc essentielles pour établir et maintenir l’identité cellulaire pendant le développement. Ces interactions sont difficiles à étudier dans l'ensemble du génome en raison de l'énorme complexité des contacts possibles à l'intérieur du noyau, où plus de 2 m d'ADN sont condensés dans l’espace minuscule du noyau cellulaire d'environ 10m de diamètre.
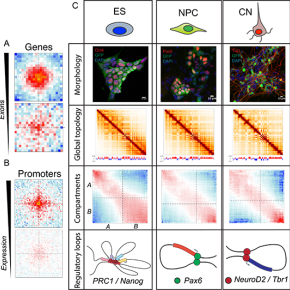
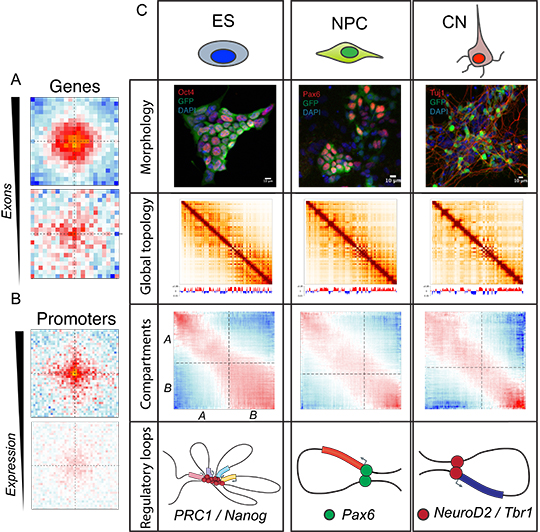
En utilisant une nouvelle approche combinant la purification des populations de types cellulaires spécifiques in vivo, suivie d’une cartographie de leur architecture nucléaire 3D avec une résolution spatiale sans précédent, les chercheurs montrent que les changements dans l’organisation du génome se produisent à des échelles spatiales multiples pendant le développement du cerveau de la souris. Ils observent que, lorsque les gènes sont activés, ils sont généralement associés à la définition de frontières capables d’isoler des domaines chromosomiques des régions génomiques adjacentes. Cependant, l’induction de la transcription par des techniques de génie génétique (CRISPR/Cas9) n’est pas suffisante pour créer de telles frontières, ce qui suggère qu’elles sont définies par des facteurs spécifiques qui demeurent inconnus. En outre, les chercheurs ont découvert que les gènes fortement épissés se contactent de manière préférentielle à l'intérieur du noyau, ce qui indique une association jusqu'alors inconnue entre le processus d’épissage de l’ARN et l'organisation 3D du génome.
Ces découvertes sont valables dans tous les types cellulaires étudiés, mais les chercheurs ont aussi identifié des contacts 3D spécifiques de chaque type cellulaire. Un réseau de contacts liés aux facteurs épigénétiques nommés Polycomb, est très prononcé dans les cellules souches, mais il est fortement perturbé lors de la différenciation neurale. D’autre part, des interactions chromatiniennes entre sites fixés spécifiquement par plusieurs facteurs de transcription neuronaux sont établies durant le processus de différenciation. Par ailleurs, les chercheurs montrent que les contacts 3D entre les régions régulatrices appelés « enhancers » et les régions promotrices de leurs gènes cibles sont régulés dynamiquement et sont généralement établis au moment de l’activation de ces gènes.
Ces résultats illustrent comment l'architecture nucléaire 3D est fortement liée à la fonction physiologique et pathologique normale du cerveau in vivo. Ils ont des implications pour la compréhension de plusieurs maladies liées au cerveau telles que le handicap intellectuel et l'autisme, qui sont fréquemment associés aux processus de remodelage de la chromatine
© Boyan Bonev
© Illustration résumé : Elisa Cavalli
En savoir plus
-
Bonev, B., Mendelson Cohen, N., Szabo, Q., Fritsch, L., Papadopoulos, G., Lubling, Y., Xu, X., Lv, X., Hugnot, J.-P., Tanay, A, and Cavalli, G. (2017). Multi-scale 3D genome rewiring during mouse neural development.
Cell Volume 171, Issue 3, p557–572.e24, 19 October 2017DOI: http://dx.doi.org/10.1016/j.cell.2017.09.043