La mécanotransduction activée par de simples fluctuations de la forme des cellules déclenche la gastrulation
L’équipe d’Emmanuel Farge à l’Institut Curie, en collaboration avec des chercheurs de l’Institut Néel, démontre que la gastrulation peut être réactivée chez un embryon de drosophile déficient en mimant, grâce à des micro-aimants oscillants, les pulsations des cellules du mésoderme. Cette étude publiée le 23 janvier 2017 dans la revue Nature Communications, démontre que le processus actif qui provoque la gastrulation, première étape de la morphogenèse embryonnaire animale, est déclenché mécaniquement.
A l’origine de notre propre développement embryonnaire, nous partageons avec l’ensemble des organismes animaux, cette étape cruciale qui initie le développement embryonnaire depuis plus de 800 millions d’années : la gastrulation. Celle-ci consiste en la formation de grands domaines tissulaires qui s’internalisent au sein de l’embryon précoce, souvent sous la forme de tubes, et qui vont constituer les organes de l’animal adulte, tels que le tube digestif, le cœur, les muscles et les reins, ou encore les poumons chez les organismes les plus complexes.
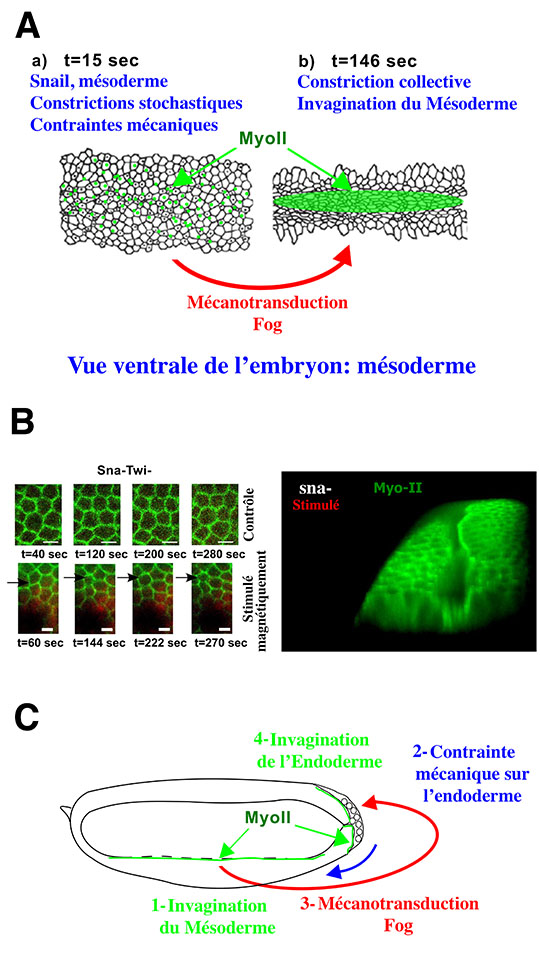
Dans l’embryon de drosophile, le premier de ces tubes, le mésoderme, donnera naissance à tous les organes internes de l’organisme adulte, excepté le tube digestif. Il se forme grâce à la stabilisation, sous la surface cellulaire extérieure de l’embryon, du moteur moléculaire Myosine II (Myo-II), qui a pour fonction de contracter cette surface externe du tissu, et par là même d’induire sa courbure vers l’intérieur pour former le tube de tissu interne mésodermique. Cette contraction s’effectue en deux temps. Les cellules se contractent d’abord de façon irrégulière et instable du fait du dépôt erratique et fluctuant de foyers contractiles de Myo-II au niveau des apex cellulaires. Puis, elles se contractent de façon stable et coordonnée avec la stabilisation des foyers de Myo-II qui s’accumulent progressivement aux apex.
Les chercheurs ont démontré que les contraintes mécaniques développées par les fluctuations de la forme des cellules activent la stabilisation apicale de la Myo-II, et déclenchent ainsi le processus actif d’invagination du mésoderme (Fig. A). Pour ce faire, ils ont utilisé un mutant du gène snail dont les cellules du mésoderme ne fluctuent plus, et ne montre de ce fait plus d’activation de leur invagination. Ils ont mimé par voie magnétique les fluctuations de forme des apex cellulaires dont l’amplitude est de l’ordre de 500 nanomètres seulement. Des liposomes ultra-magnétiques ont été injectés dans les cellules du mésoderme et un réseau de micro-aimants, dont la taille individuelle de 10 microns est de l’ordre de la taille des cellules, a été approché à quelques microns de l’embryon. Le champ magnétique local de ces micro-aimants ayant la particularité d’être modulable dans le temps, une oscillation des champs magnétiques micrométriques locaux a été induite de telle sorte que les apexs des cellules se sont mis à pulser, exactement comme dans l’embryon non muté (Fig. B-gauche). En réponse à cette stimulation mécanique, les chercheurs ont observé la stabilisation apicale de la Myo-II, et le déclenchement de l’invagination du mésoderme (Fig-B-droite). Ils ont également établi que cette stimulation résulte de l’activation mécanique de la voie de signalisation intracellulaire Fog.
Enfin, les chercheurs ont montré, à nouveau par voie magnétique, que les déformations mécaniques des cellules de l’endoderme du pole postérieur de l’embryon (futur tube gastrique postérieur de l’embryon), provoquées cette fois par l’invagination du mésoderme, y déclenchent la stabilisation apicale de la Myo-II et enclenchent la formation du tube gastrique (Fig. C).
Cette étude démontre que le déclenchement de la gastrulation, correspondant aux tout premiers mouvements morphogénétiques actifs initiant l’embryogenèse chez tous les organismes animaux depuis leur origine évolutive, est provoqué dans l’embryon de drosophile, dont la régulation biochimique est l’une des mieux caractérisée du règne animal, par un processus actif de déclenchement mécanique de la stabilisation apicale de la Myo-II générant l’invagination de l’endoderme et du mésoderme.
© Démosthène Mitrossilis. Emmanuel Farge. Nature publishing group.
En savoir plus
-
Mechanotransductive cascade of Myo-II-dependent mesoderm and endoderm invaginations in embryo gastrulation.
Mitrossilis D, Röper JC, Le Roy D, Driquez B, Michel A, Ménager C, Shaw G, Le Denmat S, Ranno L, Dumas-Bouchiat F, Dempsey NM, Farge E.
Nat Commun. 2017 Jan 23;8:13883. doi: 10.1038/ncomms13883.