Une nouvelle classe d’ARN antisens régulateurs de l’expression génique
La sénescence cellulaire est une barrière anti-cancer caractérisée par un arrêt stable de la prolifération cellulaire en réponse à différents stress. Des chercheurs du Laboratoire de biologie cellulaire et moléculaire du contrôle de la prolifération, ont identifié en sénescence une nouvelle classe d’ARN antisens régulateurs de l’expression génique qui sont produits sur des gènes convergents à cause de défauts de terminaison de la transcription. La production de ces ARN est régulée par la structure de la chromatine et la vitesse d’élongation de la transcription en aval de ces gènes. Ces travaux, publiés le 28 novembre 2017 dans la revue Cell Reports, soulignent l’importance du contrôle épigénétique des régions intergéniques pour l’expression correcte du génome.
La sénescence cellulaire est caractérisée par un arrêt stable de la prolifération cellulaire en réponse à différents stress comme l’activation d’oncogène. Elle est ainsi considérée comme une barrière anti cancer majeure. Cependant, l’accumulation de cellules sénescentes peut engendrer des maladies liées au vieillissement normal et pathologique. La sénescence cellulaire s’accompagne de la mise en place d’un programme génique spécifique et de changements dans la structure de la chromatine. Les longs ARN non-codants (ARNnc) participent à la régulation de l’expression génique en agissant notamment sur la structuration de la chromatine.
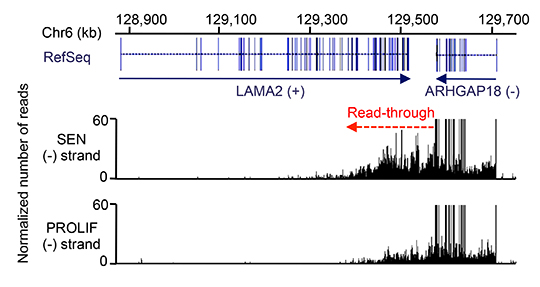
Les chercheurs se sont intéressés à l’identification de nouveaux longs ARNnc comme nouveaux acteurs dans le contrôle de la sénescence cellulaire. Dans ce but, ils ont analysé, de manière indépendante de l’annotation connue du génome, des données à grande échelle mesurant l’expression génique de façon brin-spécifique en sénescence. Ils ont découvert une nouvelle classe d’ARNnc produits sur des gènes convergents (deux gènes adjacents en orientation inverse dans le génome) par un défaut de terminaison de la transcription d’un des deux gènes convergents (voir Figure 1).
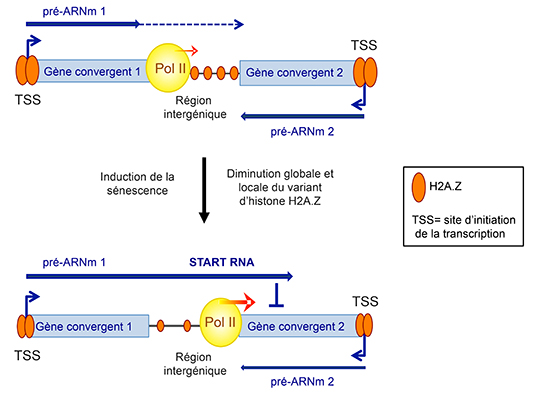
Ces ARN, appelés START RNAs (Senescence-Triggered Antisense Read-Through RNAs), sont en orientation antisens (opposée) à l’autre gène du couple de gènes convergents et répriment l’expression génique de ce dernier. La production de ces ARN régulateurs est augmentée en sénescence par des mécanismes impliquant la régulation de la localisation du variant d’histone H2A.Z ainsi qu’une augmentation de la vitesse d’élongation de l’ARN polymérase II (pol II) en aval du site de terminaison.
Ces travaux mettent en évidence un nouveau mécanisme de régulation rapide de l’expression génique sans nouvel événement d’initiation de la transcription, basé sur le contrôle épigénétique de la vitesse d’élongation par l’ARN pol II en aval des gènes. Ceci suggère l’importance du positionnement et de l’orientation des gènes dans le génome ainsi que du contrôle épigénétique des régions intergéniques pour la régulation de l’expression génique. De plus, les START RNAs, en tant que nouveaux acteurs du programme génique de la sénescence, pourraient jouer des rôles importants dans le vieillissement cellulaire normal et pathologique ainsi que dans les mécanismes suppresseurs de tumeur.
© Estelle Nicolas
© Estelle Nicolas
En savoir plus
-
Control of Gene Expression in Senescence through Transcriptional Read-Through of Convergent Protein-Coding Genes.
Muniz L, Deb MK, Aguirrebengoa M, Lazorthes S, Trouche D, Nicolas E.
Cell Rep. 2017 Nov 28;21(9):2433-2446. doi: 10.1016/j.celrep.2017.11.006.