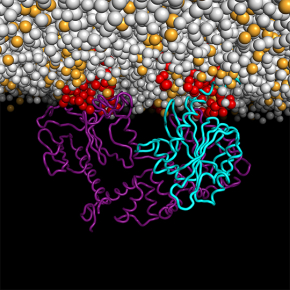
Les multiples interactions d’une petite GTPase à la surface des membranes
Pour répondre aux variations de son environnement, les cellules assemblent à la périphérie des membranes des interrupteurs moléculaires dont l’organisation structurale reste mal comprise. Le laboratoire de Jacqueline Cherfils à l’Ecole normale supérieure Paris-Saclay, en collaboration avec l’équipe de John Kuriyan à l’University of California, Berkeley (USA), dévoile comment l’un de ces interrupteurs, constitué d’une petite GTPase et d’un régulateur, interagit à la surface d’une bicouche lipidique. Ces résultats publiés le 18 septembre 2017 dans la revue PNAS, peuvent désormais guider la découverte de petites molécules inhibitrices.
Les petites GTPases forment une grande famille de protéines qui fonctionnent comme des interrupteurs moléculaires pour permettre à chaque cellule de prendre des décisions et organiser une réponse appropriée aux signaux qu’elle reçoit en permanence. A la mesure de l’importance de leurs fonctions cellulaires, ces protéines sont également défectueuses ou détournées dans de nombreuses pathologies, comme des cancers et des infections. Les petites GTPases possèdent un cortège de protéines régulatrices et de protéines effectrices, qui s’assemblent et se défont de façon dynamique à la surface des membranes cellulaires.
Un défi de la biologie moderne est de comprendre l’organisation structurale de ces complexes de signalisation à la périphérie des membranes et leurs interactions avec les lipides. Cependant, contrairement aux protéines transmembranaires pour lesquelles il est possible d’incorporer l’environnement membranaire dans un cristal, l’étude structurale des protéines périphériques de la membrane dans leur contexte membranaire manque d’outils d’observation directe à haute résolution. L’alternative est de combiner plusieurs approches structurales et biophysiques et de recouper leurs observations.
Cette étude qui combine cristallographie, simulation et reconstitution des protéines dans des membranes artificielles pour observer un de ces interrupteurs, constitué d’une petite GTPase en interaction simultanée avec une membrane et un activateur, illustre le potentiel de cette approche. Dans une première étape, Jacqueline Cherfils, invitée comme Visiting Professor du prestigieux Miller Institute for Basic Research in Science de l’Université de Californie à Berkeley, a effectué, en collaboration avec l'équipe de John Kuriyan, une étude de dynamique moléculaire dite “coarse-grained”. Ces simulations ont permis de prédire que le complexe constitué des deux protéines, dont l’une est modifiée par un lipide, forme de multiples interactions avec les lipides membranaires, et favorise une concentration de lipides de signalisation dans son voisinage. Ces prédictions ont ensuite été établies expérimentalement par l’équipe française en reconstituant le système dans des membranes artificielles.
Les résultats expliquent l’extrême efficacité de cette petite GTPase à la périphérie des membranes. Plus largement, ils apportent un nouvel éclairage sur la structure et les interactions des petites GTPases et leurs partenaires à la surface des membranes, qui à son tour peut guider des stratégies innovantes d’inhibition par des petites molécules dans des maladies.
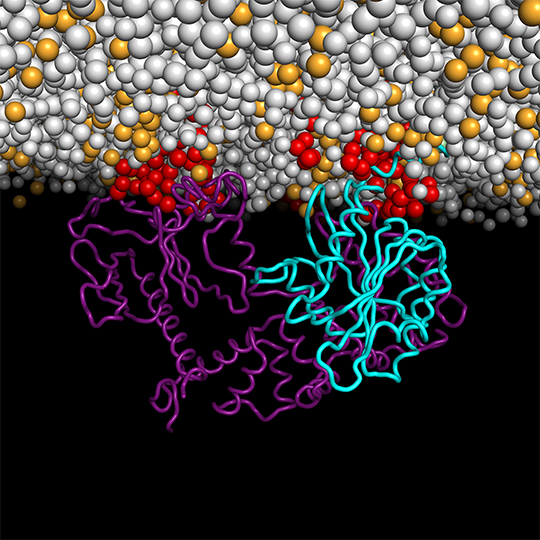
© Jacqueline Cherfils
En savoir plus
-
Multiple interactions between an Arf/GEF complex and charged lipids determine activation kinetics on the membrane.
PNAS. 2017 Sep 18. pii: 201707970. doi: 10.1073/pnas.1707970114
Karandur D, Nawrotek A, Kuriyan J, Cherfils J.