Un nouveau mécanisme de contrôle de la pluripotence dans l'embryon
Dans le très jeune embryon, les cellules naissent dans un état pluripotent avant de s'engager progressivement dans de multiples lignages au sein des trois feuillets germinaux, ectoderme, mésoderme, endoderme. Sans maintien d'un bon équilibre entre pluripotence et engagement, le développement de l'embryon est voué à l'échec. L'équipe de Laurent Kodjabachian à l'Institut de biologie du développement de Marseille, vient d'identifier un nouveau mécanisme nécessaire au maintien de cet équilibre. Cette étude a été publiée le 27 juin 2017 dans la revue eLife.
La pluripotence désigne la capacité des cellules embryonnaires à participer à tous les lignages de l'organisme (système nerveux, peau, muscle etc...) en fonction des signaux auxquels elles sont exposées. Cette propriété doit être parfaitement contrôlée pour assurer un développement progressif et correct de l'embryon. Si les cellules embryonnaires restent pluripotentes trop longtemps, le développement s'interrompt; si au contraire elles s'engagent trop vite, certains territoires ne se forment pas. Dès lors, on comprend qu'il est essentiel d'élucider les mécanismes de contrôle de la transition entre pluripotence et engagement.
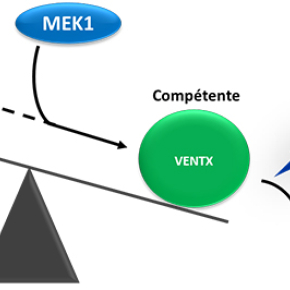
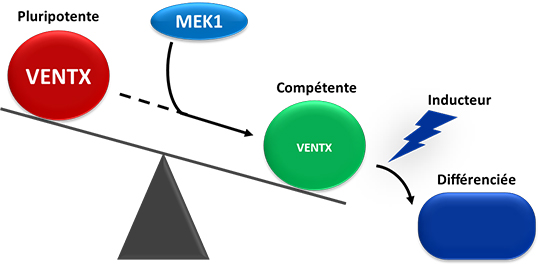
Les bases moléculaires de la pluripotence sont le plus souvent étudiées dans des cultures in vitro de cellules souches embryonnaires murines ou humaines. Il ressort de ces études que la pluripotence est soutenue par un réseau de facteurs de transcription, parmi lesquels Nanog joue un rôle central. Lorsque ce réseau s'éteint, les cellules deviennent compétentes à s'engager dans un des multiples lignages qui composent l'embryon. On sait que la kinase MEK1, qui agit dans la voie MAPK, promeut la transition entre l'état pluripotent et compétent des cellules souches embryonnaires.
Les chercheurs ont utilisé l'embryon de l'amphibien xénope pour élucider le mode d'action de MEK1 in vivo. Il est apparu que la déplétion de MEK1 empêche le développement embryonnaire; les cellules restent bloquées dans un état pluripotent et sont totalement incapables de répondre à des signaux inducteurs de différenciation. Le genre Xenopus a perdu le gène Nanog, mais sa fonction est assurée par un proche cousin, appelé Ventx (Scerbo et al., 2012). En condition normale, la protéine Ventx est progressivement éliminée et son extinction en fin de gastrulation signe la fin de la phase de pluripotence. En absence de MEK1, la protéine Ventx n'est plus dégradée, mais le développement peut-être restauré lorsque Ventx et MEK1 sont inhibés conjointement. L'axe MEK1/Ventx est donc au cœur de la transition pluripotence/engagement (Figure 1).
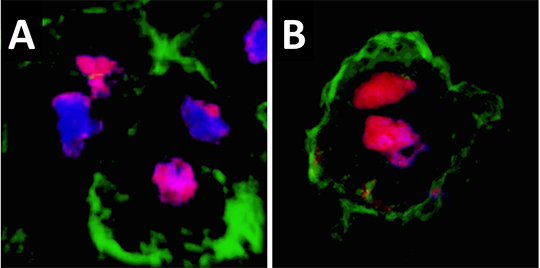
La surprise vint lors de l'analyse par immunofluorescence de la distribution de la protéine Ventx au niveau cellulaire. En condition normale, une fraction significative des divisions mitotiques des cellules pluripotentes montre une répartition inégale de Ventx entre les deux noyaux fils (Figure 2A). En revanche, lorsque MEK1 n'agit plus, les divisions deviennent symétriques et les deux noyaux fils héritent d'une quantité équivalente de Ventx (Figure 2B). Ce mécanisme de répartition asymétrique de Ventx à la mitose pourrait ainsi permettre d'assurer le maintien du pool de cellules pluripotentes tout en délivrant régulièrement des cellules fondatrices pour bâtir les premiers tissus embryonnaires. Il reste à déterminer comment MEK1 contrôle la répartition asymétrique de Ventx.
Ce mécanisme est-il particulier au xénope ou est-il commun à toutes les espèces? Le genre rongeur a perdu Ventx mais Nanog pourrait être sujet au même type de contrôle, ce qui peut être testé chez la souris. En revanche, l'homme a conservé à la fois Nanog et Ventx. Tous deux sont exprimés dans les cellules souches embryonnaires, ainsi que dans les cellules souches cancéreuses. Sur la base des études réalisées sur le xénope, il sera important d'évaluer le rôle de Ventx dans le contrôle de la pluripotence chez l'homme. Au delà, il faudra déterminer si là aussi, MEK1 contrôle la stabilité et la distribution asymétrique de Ventx et de Nanog pendant la division des cellules souches, une question d'intérêt notamment dans le champ du cancer.
© Pierluigi Scerbo
© Laurent Kodjabachian
En savoir plus
-
Lineage commitment of embryonic cells involves MEK1-dependent clearance of pluripotency regulator Ventx2.
Scerbo P, Marchal L, Kodjabachian L.
Elife. 2017 Jun 27;6. pii: e21526. doi: 10.7554/eLife.21526.