Rigidité tissulaire + Forces mécaniques = Equation du développement
Dans les dernières étapes de son développement, l’embryon du ver Caenorhabditis elegans change de forme et accroit quatre fois sa longueur sans migration ni division cellulaires. L’équipe de Michel Labouesse à l’Institut de Biologie Paris-Seine, démontre que cette élongation est basée sur deux composantes physiques : les forces mécaniques générées dans un tissu et la rigidité d’autres tissus. Ces résultats ont été publiés le 9 février 2017 dans la revue eLife.
Comment à partir d’une seule cellule, différentes espèces acquièrent-elles des formes si variées? Quels sont les principes biologiques et physiques qui contrôlent la déformation d’un tissu? Pour répondre à ces questions, l’équipe de Michel Labouesse1 à l’Institut de Biologie Paris-Seine, utilise le ver Caenorhabditis elegans (C. elegans), qui partage des mécanismes cellulaires communs avec les humains tout en étant bien plus simple à étudier au laboratoire.
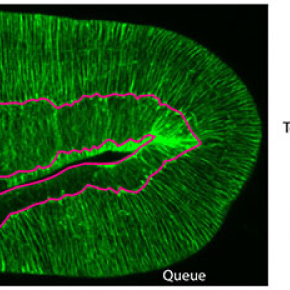
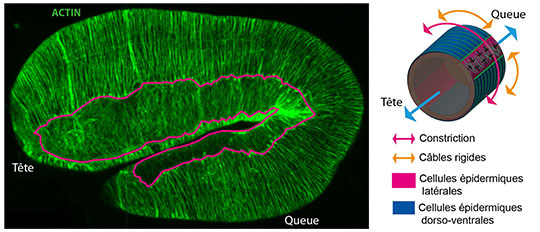
Vers la fin de son développement, l’embryon de C. elegans passe d’une forme ovoïde à une forme cylindrique. Il s’étire pour devenir quatre fois plus long dans l’axe tête-queue (ou antéro-postérieur) et environ deux fois plus petit en diamètre. Ce processus nécessite un moteur moléculaire appelé myosine, aussi connu pour son rôle dans les contractions musculaires, et un réseau de polymères appelé actine qui confère aux cellules leurs propriétés mécaniques. Ces molécules agissent dans l’épiderme de C. elegans,qui est organisé en cellules dorsales, ventrales et deux rangées de cellules latérales qui relient les cellules dorsales et ventrales, l’activité des moteurs de myosine se concentrant seulement dans les deux rangées de cellules latérales sur les deux côtés de l’embryon. Les chercheurs ont étudié comment cette distribution des moteurs myosine allonge l’embryon spécifiquement dans la direction antéro-postérieure.
Pour répondre à ces questions, Thanh Vuong-Brender, au sein de l'équipe de Michel Labouesse, a développé une démarche expérimentale interdisciplinaire alliant la physique et la biologie, en collaboration avec Martine Ben Amar, Professeur de Physique à l’Ecole Normale Supérieure à Paris, pour mettre en équations la déformation de l’embryon du ver. Leur travail explique pour la première fois la mécanique de l’extension d’un tissu complexe in vivo.
En pratique, les chercheurs ont cartographié les forces mécaniques qui s’exercent tout le long de l’embryon par la technique d’ablation laser. Ceci consiste à réaliser des microcoupures dans une cellule donnée du tissu et à observer comment s’ouvre la plaie ainsi formée. La forme de l’ouverture est indicative des forces qui s’exercent au niveau de la coupure, comme lors de la déchirure d’une étoffe dont on étirerait les deux bords.
En utilisant cette méthode, les chercheurs ont montré que les moteurs de myosine de l’embryon de C. elegans, bien qu’actifs principalement dans les cellules latérales, induisent des constrictions autour de l’embryon (avec un effet similaire à celui qu’un boa inflige à sa proie) afin de réduire son diamètre et de l’allonger dans l’axe antéro-postérieur. Pour mieux comprendre les résultats expérimentaux, l’équipe a proposé un modèle mécanique permettant d’expliquer les changements de forme. Selon ce modèle, l’embryon de C. elegans ressemble à un ballon de baudruche rempli d’eau. Les constrictions le long de la circonférence augmentent la pression du liquide cellulaire contenu dans l’embryon, aidant à pousser la tête et la queue progressivement plus loin l’une de l’autre. Quant aux autres cellules, dorsales et ventrales, les mesures ont montré qu’elles agissent de façon complémentaire. Leur réseau d’actine forme des câbles parallèles rigides le long de la circonférence, similaire à une ceinture, qui empêchent la section de l’embryon de s’agrandir. Les deux types cellulaires coopèrent ainsi pour assurer l’allongement du ver dans la direction tête-queue.
Cette étude a montré que les cellules de l’embryon contribuent à établir sa forme – on parle de morphogénèse - soit en générant des forces, soit en devenant plus souples ou plus rigides dans des directions spécifiques. La régulation et la coordination sont essentielles pour obtenir une forme fonctionnelle, donc pour éviter des malformations.
Ces résultats permettent de mieux comprendre la morphogénèse des tissus en général, quel que soit l’organisme considéré, ainsi que l’origine de certaines pathologies associées.
1. Forces mécaniques et morphogénèse des tissus.
© Thanh Vuong-Brender
En savoir plus
-
The interplay of stiffness and force anisotropies drive embryo elongation.
Thanh Thi Kim Vuong-Brender, Martine Ben Amar, Julien Pontabry Michel Labouesse.
eLife 2017;10.7554/eLife.23866. Published February 9, 2017.