L’optogénétique révèle comment les adhésions régulent les moteurs de la morphogénèse tissulaire
La morphogenèse des tissus est dirigée par des forces bio-mécaniques générées par des moteurs moléculaires tels que la myosine. Grâce à l’utilisation d’une nouvelle technique d’optogénétique, l’équipe de Xiaobo Wang au Laboratoire de biologie cellulaire et moléculaire du contrôle de la prolifération, en collaboration avec des chercheurs de l'Institut supérieur coréen des sciences et technologies, montre que les adhésions contrôlent la contractilité de la myosine afin de réguler l’élongation du tissu ovarien chez la drosophile. Ces travaux ont été publiés le 13 avril 2017 dans la revue Nature Communications.
La compréhension des mécanismes qui gouvernent la formation des tissus et des organes est une question fondamentale en biologie. Les réseaux d’actomyosine jouent un rôle crucial dans la morphogénèse tissulaire. La contractilité de la myosine, souvent en mode oscillatoire, a été étudiée principalement au niveau du domaine apical des cellules épithéliales au cours du développement mais très peu au niveau de leur domaine basal. Cependant, l’oscillation de la myosine basale est importante pour le contrôle de l’élongation du tissu folliculaire ovarien chez la drosophile. Bien que la voie de signalisation Rho1-ROCK-myosine soit connue pour contrôler l’activité de la myosine, les mécanismes en amont de cette voie n’ont pas encore été élucidés.
En prenant comme modèle d’étude l’ovaire de drosophile, l’équipe de Xiaobo Wang s’est intéressée à l’effet des adhésions cellule-cellule et cellule-matrice dans le contrôle des voies de signalisation gouvernant l’oscillation de la myosine basale. Les chercheurs montrent ainsi que les adhésions cellule-matrice régulent positivement l’activité de Rho1 au niveau des jonctions membranaires et gouvernent les oscillations de ROCK et de la myosine à l’intérieur de la cellule, contrôlant ainsi l’élongation du tissu. Concernant les adhésions cellule-cellule, celles-ci affectent indirectement les oscillations de ROCK et de la myosine en contrôlant la distribution subcellulaire de ROCK et du réseau d’actomyosine. En effet, l’inhibition des adhésions cellule-cellule, qui a un effet mineur sur l’élongation du tissu, provoque la redistribution des adhésions cellule-matrice et des filaments d’actine au niveau des jonctions membranaires enrichissant ainsi les oscillations de la myosine près des contours cellulaires.
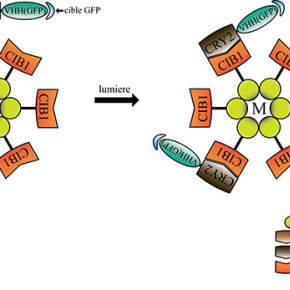
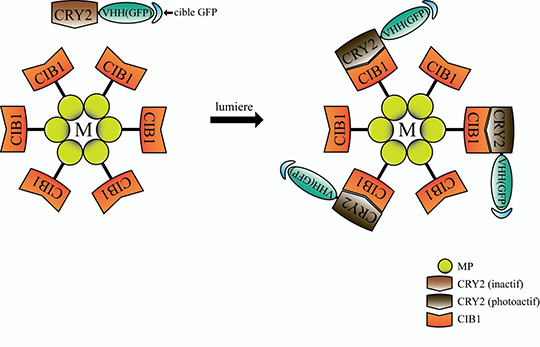
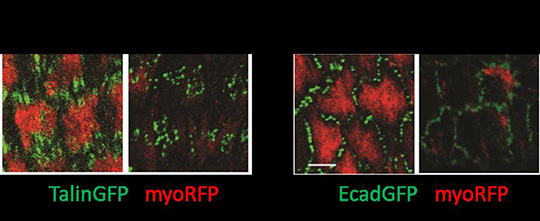
L’ensemble de ces résultats a été obtenu chez la drosophile grâce à des modèles génétiques permettant l’expression ectopique ou l’inhibition à long terme des composants des adhésions cellule-matrice et cellule-cellule. Pour s’affranchir de ces effets à long terme et visualiser rapidement l’action des composants des adhésions, l’équipe de Xiaobo Wang, en collaboration avec l’équipe de Won Do Heo (République de Corée), a utilisé pour la première fois in vivo une nouvelle technique d’optogénétique appelée GFP-LARIAT. Cet outil permet d’inhiber à volonté au niveau spatial et temporel la fonction de diverses protéines étiquetées par la protéine fluorescente GFP (Figure 1). Plus précisément, l’application in vivo de la lumière sur des tissus exprimant les composants du système GFP-LARIAT, entraîne en quelques minutes une agrégation et donc une inhibition des protéines cibles couplées à la GFP. Ainsi, l’illumination par la lumière a permis de réprimer localement et rapidement la fonction des protéines impliquées dans les adhésions cellule-matrice (intégrine-GFP et taline-GFP) et les adhésions cellule-cellule (E-cadherine-GFP) et de confirmer les différents effets des adhésions sur le contrôle dynamique de l’élongation du tissu ovarien (Figure 2).
L’application in vivo de cette nouvelle technique d’optogénétique devrait permettre d’illuminer la fonction dynamique d’un grand nombre de protéines impliquées dans divers processus biologiques fondamentaux.
© Xiaobo Wang et Jiaying Liu
© Xiaobo Wang et Xiang Qin
En savoir plus
-
Cell-matrix adhesion and cell-cell adhesion differentially control basal myosin oscillation and Drosophila egg chamber elongation.
Qin X, Park BO, Liu J, Chen B, Choesmel-Cadamuro V, Belguise K, Heo WD, Wang X.
Nat Commun. 2017 Apr 13;8:14708. doi: 10.1038/ncomms14708.