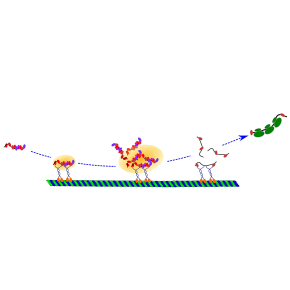
Découverte du mécanisme de régulation de l’expression des « immune checkpoints »
Les nouvelles immunothérapies anticancéreuses bloquent des récepteurs freins de réponse immunitaire, nommés immune checkpoints, dont on ignorait le mécanisme d’expression par les lymphocytes T. Cette étude, publiée dans la revue Cell Reports, démontre que les lymphocytes T activés déploient un mécanisme de contrôle pré-traductionnel de l’ARNm des immune checkpoints durant leur transport microtubulaire sous forme de granules de stress, à l’instar du contrôle d'expression des récepteurs synaptiques par les neurones.
Les "immune checkpoints inhibiteurs", comme par exemple PD-1, sont des récepteurs exprimés par les lymphocytes T et qui jouent un rôle de frein immunitaire malheureusement responsable de l'insuffisante immunité antitumorale qui caractérise la plupart des patients souffrant de cancer. La révolution thérapeutique actuelle en cancérologie consiste à bloquer ces récepteurs par des anticorps monoclonaux. Les résultats des essais cliniques de ces anticorps sont remarquables dans la plupart des cancers dus à de nombreuses mutations. Cependant, le mécanisme par lesquels les lymphocytes T contrôlent l’expression de ces importants freins est inconnu.
Les chercheurs ont réussi à identifier ce mécanisme, qui s'avère similaire à celui par lequel les neurones contrôlent l'expression de leurs récepteurs à l'extrémité des synapses nerveuses. Il a été observé que, pendant la stimulation des lymphocytes T humains normaux, les ARN messagers des "immune checkpoints" s’associent à des complexes ribonucléiques pour former des granules appelées granules de stress. Ces granules de stress sont embarqués par la protéine kinésine 1, un moteur moléculaire qui les achemine dans le cytoplasme tout le long des microtubules jusqu'aux ribosomes pour y être traduits en protéine directement sous la membrane cellulaire. Curieusement, dans tous les types de lymphocytes T activés, ce mécanisme général contrôle ainsi la production de tous les "immune checkpointsinhibiteurs", mais d'aucun "immune checkpointactivateur". Enfin, l'assemblage des granules de stress, et celui du réseau microtubulaire peuvent être bloqués par certaines molécules et médicaments utilisés en chimiothérapie. Ces derniers empêchent donc la traduction des ARNm contenus dans les granules, notamment ceux de PD-1 et des autres "immune checkpoints inhibiteurs".
Cette étude révèle les effets de certaines chimiothérapies qui altèrent les lymphocytes T infiltrant les tumeurs de patients cancéreux, augmentant ainsi le risque d'effets secondaires auto-immuns à l'instar des anticorps anti-immune checkpoints. Elle met en lumière un nouveau mécanisme de régulation immunitaire important pour de potentielles stratégies thérapeutiques.
© JJ Fournié
En savoir plus
-
Microtubule-Driven Stress Granule Dynamics Regulate Inhibitory Immune Checkpoint Expression in T Cells.
Franchini DM, Lanvin O, Tosolini M, Patras de Campaigno E, Cammas A, Péricart S, Scarlata CM, Lebras M, Rossi C, Ligat L, Pont F, Arimondo PB, Laurent C, Ayyoub M, Despas F, Lapeyre-Mestre M, Millevoi S, Fournié JJ.
Cell Rep. 2019 Jan 2;26(1):94-107.e7. doi: 10.1016/j.celrep.2018.12.014.