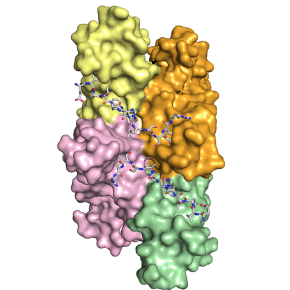
Base structurale de l’addiction de systèmes toxine-antitoxine à un chaperon moléculaire
Chez les bactéries, les systèmes toxine-antitoxine peuvent faciliter l’adaptation au stress ainsi que l’établissement de phénomènes de persistance et de virulence. Les chercheurs ont déterminé les bases structurales gouvernant le phénomène d’addiction de systèmes toxine-antitoxine à un chaperon moléculaire chez le pathogène humain Mycobacterium tuberculosis. Ces travaux sont publiés dans la revue Nature Communications.
Les systèmes toxine-antitoxine sont des éléments génétiques capables de contrôler la croissance bactérienne en réponse à certains stress. Ils sont généralement composés d’une toxine et d’une antitoxine qui inhibe l’effet délétère de la toxine. Dans certaines conditions de stress, l’antitoxine, moins stable, est dégradée et la toxine ainsi libérée peut contrôler la croissance bactérienne en ciblant par exemple la réplication ou la synthèse de novo des protéines. L’implication de certains de ces systèmes dans les phénomènes de persistance bactérienne et dans la virulence de certains pathogènes en fait des cibles thérapeutiques d’intérêt.
Mycobacterium tuberculosis, la bactérie responsable de la tuberculose, cause près de deux millions de décès chaque année dans le monde et demeure un problème majeur de santé publique. M. tuberculosis possède un très grand nombre de systèmes toxine-antitoxine (plus de 80) aux fonctions inconnues et il a été proposé que ces systèmes puissent être impliqués dans l’établissement de la phase de persistance chez cette bactérie.
Parmi ces systèmes toxine-antitoxine, le système TAC (Toxine-Antitoxine-Chaperonne) est un système atypique en ce qu’il est contrôlé par un troisième partenaire obligatoire: un chaperon moléculaire qui facilite le repliement et empêche la dégradation de l’antitoxine. De façon remarquable, la dépendance de ce système toxine-antitoxine à l’égard du chaperon est déterminée par une petite région de l’antitoxine, appelée ChAD (pour "chaperon addiction"), qui interagit spécifiquement avec le chaperon et induit l’agrégation de l’antitoxine en absence de ce dernier.
En utilisant le système TAC de M. tuberculosis comme système d’étude, les chercheurs viennent de résoudre la structure cristallographique du chaperon en complexe avec la séquence ChAD de l’antitoxine, révélant ainsi les bases moléculaires du phénomène d’addiction de systèmes toxine-antitoxine à un chaperon. De plus, cette structure et la caractérisation biochimique et biophysique exhaustive du complexe ont permis de montrer que l’interaction entre le chaperon et l’antitoxine pouvait être déstabilisée in vitro et in vivo, induisant une activation contrôlée de la toxine.
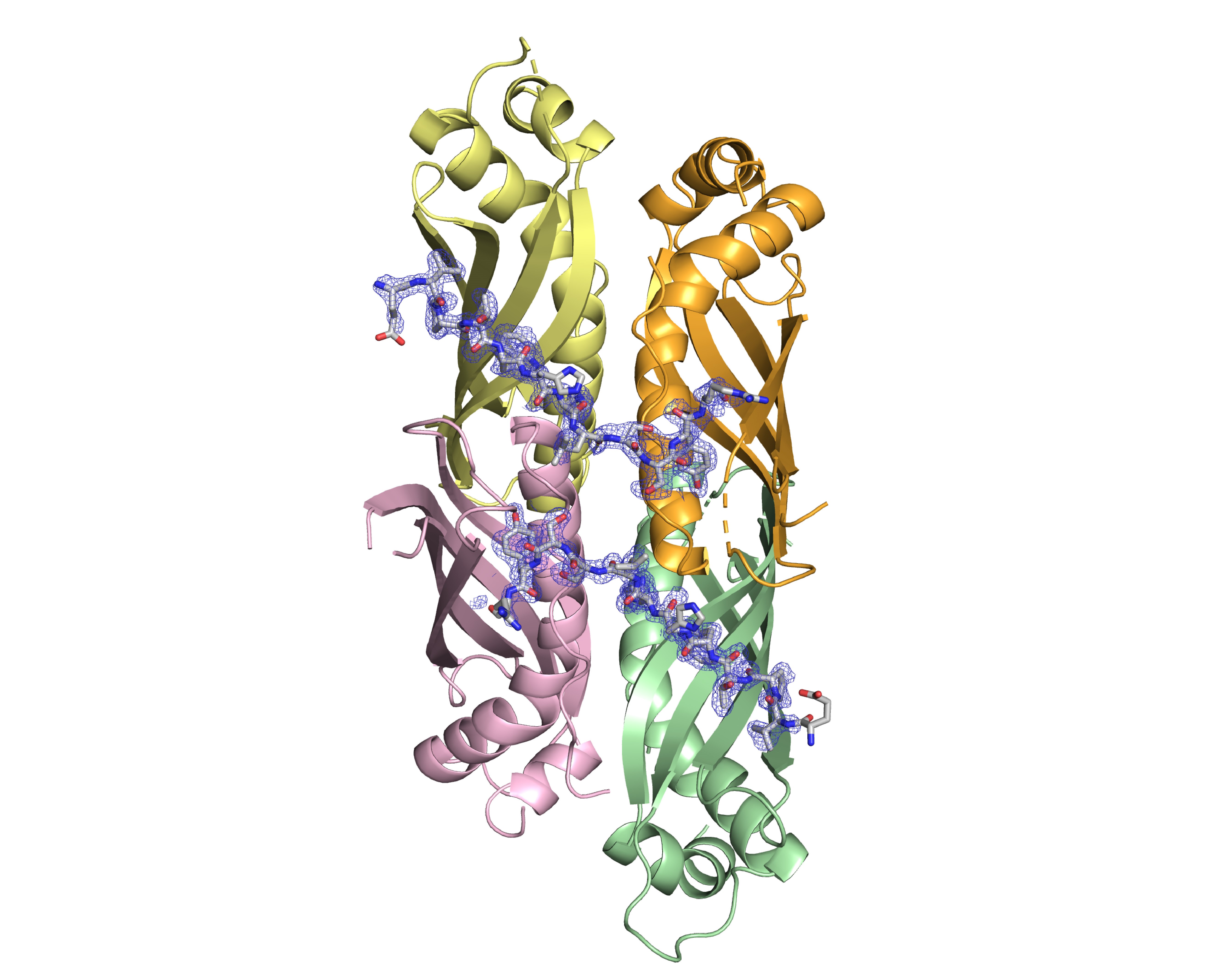
© Lionel Mourey
En savoir plus
-
Structural insights into chaperone addiction of toxin-antitoxin systems.
Guillet V, Bordes P, Bon C, Marcoux J, Gervais V, Sala AJ, Dos Reis S, Slama N, Mares-Mejía I, Cirinesi AM, Maveyraud L, Genevaux P, Mourey L.
Nat Commun. 2019 Feb 15;10(1):782. doi: 10.1038/s41467-019-08747-4.