Immunothérapie : comment agissent les anticorps thérapeutiques ?
Depuis la fin des années 1990, l’immunothérapie est la première ligne de traitement contre les lymphomes. Cette stratégie est basée sur l’utilisation d’anticorps de synthèse pour enrayer la prolifération des globules blancs cancéreux. Mais plus de 20 ans après leur première utilisation, les mécanismes moléculaires sur lesquels repose ce traitement restent peu connus. Pour la première fois, des scientifiques du CNRS, de l’Institut Pasteur et de l’Université de Bordeaux ont observé l’interaction entre les anticorps thérapeutiques et leur protéine cible. Ces travaux, publiés dans la revue Science le 14 août, décrivent ces mécanismes moléculaires et ouvrent des perspectives dans la conception de nouveaux traitements.
Les lymphomes non hodgkiniens sont parmi les cancers les plus fréquents et touchent près d’un million et demi de personnes dans le monde. Ils induisent une prolifération incontrôlée des lymphocytes B, un type de globules blancs, au détriment des cellules saines. Depuis la fin des années 1990, l’un des traitements de première ligne est l’immunothérapie. Celle-ci utilise des anticorps de synthèse qui ciblent une protéine de la surface des lymphocytes B, la CD20. Les défenses du corps humain identifient alors comme pathogènes ces cellules recouvertes d’anticorps et les détruisent.
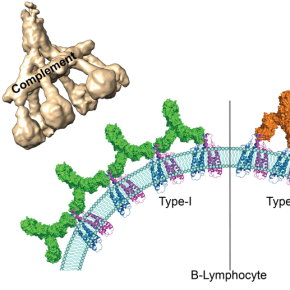
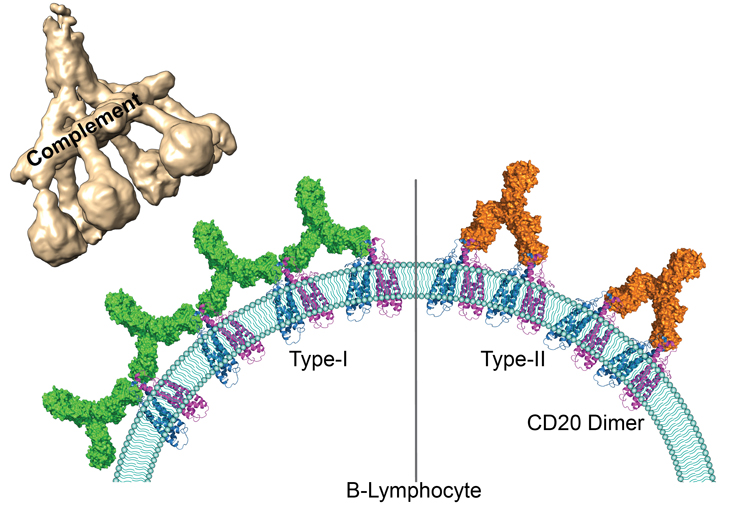
Les anticorps thérapeutiques utilisés actuellement peuvent être classés en deux groupes selon le nombre de molécules de CD20 auxquelles ils peuvent se lier et selon les réactions immunitaires qu’ils déclenchent. Ainsi les anticorps du premier groupe ont la capacité d’interagir avec deux fois plus de molécules de CD20 que les anticorps du second groupe et peuvent activer une cascade de réactions immunitaires appelée « voie du complément ». Or, jusqu’à présent, les mécanismes moléculaires à l’origine des différences entre les deux groupes étaient inconnus.
Pour la première fois, des chercheurs du CNRS, de l’Institut Pasteur et de l’Université de Bordeaux1 ont obtenu par cryo-microscopie électronique, des images de l’interaction entre les principaux représentants des deux groupes d’anticorps et leurs molécules cibles, au niveau de l’atome. Ils ont montré que pour des raisons de disponibilité spatiale, les protéines CD20 peuvent se lier à deux anticorps du type 1 contre seulement un anticorps du type 2. Les anticorps du type 1, en plus grand nombre sur la surface des lymphocytes B, peuvent former des amas. Les scientifiques ont montré que ces amas déclenchent la voie du complément qui conduit à la destruction des lymphocytes B ciblés. En revanche, les anticorps du type 2 restent clairsemés à la surface des cellules et n’induisent pas cette cascade de réactions. Elles sont tout de même détruites grâce à d’autres mécanismes immunitaires indépendants.
Jamais auparavant un des mécanismes d’action des anticorps thérapeutiques n’avait été décrit avec autant de précision. Ces travaux pourraient permettre de concevoir de nouveaux anticorps de synthèse capables de contrôler la réponse immunitaire du patient. De plus, cette description du mécanisme activateur de la voie du complément ouvre de nouvelles pistes de recherche afin de mieux comprendre le fonctionnement des défenses immunitaires.
© Nicolas Reyes
- 1Ont participé à ces travaux des chercheurs du laboratoire de Microbiologie fondamentale et pathogénicité (CNRS/Université de Bordeaux), du laboratoire "Immunité humorale" (Inserm/Institut Pasteur/Sorbonne Université), de l'unité "Mécanismes des protéines membranaires" (Institut Pasteur) et de l’Institut européen de chimie et biologie (Université de Bordeaux).
Binding mechanisms of therapeutic antibodies to human CD20. Anand Kumar, Cyril Planchais, Rémi Fronzes, Hugo Mouquet et Nicolas Reyes. Science, le 14 août 2020. DOI : 10.1126/science.abb8008