Production d'électricité : quand des enzymes rivalisent avec le platine
Une biopile aussi efficace qu'une pile à combustible au platine : c'est la prouesse qu'ont réussie des chercheurs du laboratoire de Bioénergétique et ingénierie des protéines (CNRS/Aix-Marseille Université), en collaboration avec le Centre de recherche Paul Pascal (CNRS/Université de Bordeaux) et l'Institut universitaire des systèmes thermiques industriels (CNRS/Aix-Marseille Université). Trois ans après leur premier prototype de biopile, les chercheurs viennent de franchir une nouvelle étape en augmentant ses performances et sa stabilité. Cette biopile pourrait, à terme, offrir une alternative aux piles à combustible nécessitant des métaux rares et coûteux, comme le platine. Leurs travaux sont publiés dans Energy & Environmental Science le 17 août 2017.
Une pile à combustible convertit l'énergie chimique de combustion de l'hydrogène en énergie électrique. Si elle est considérée comme un procédé propre – car elle ne rejette aucun gaz à effet de serre – la pile à combustible utilise néanmoins comme catalyseurs1 des métaux rares et coûteux, tel le platine, pour l'oxydation de l'hydrogène et la réduction de l'oxygène. Ces dernières années, l'identification de biocatalyseurs, des enzymes aux propriétés remarquables, a relancé très activement la recherche : leur activité de transformation de l'oxygène, mais surtout de l'hydrogène, est comparable à celle du platine. L'activité des hydrogénases était, jusqu'à récemment, inhibée par l'oxygène et donc incompatible avec une utilisation en pile.
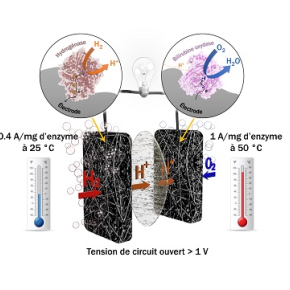
Depuis plusieurs années, des chercheurs du laboratoire de Bioénergétique et ingénierie des protéines (CNRS/Aix-Marseille Université) développent une nouvelle génération de biopiles. Ils ont remplacé le catalyseur chimique (le platine) par des enzymes bactériennes : à l'anode2, l'hydrogénase (clé de conversion de l'hydrogène dans de nombreux microorganismes), et la bilirubine oxydase à la cathode3. Ils ont donc identifié une hydrogénase active en présence d'oxygène et résistante à certains inhibiteurs du platine comme le monoxyde de carbone. En collaboration avec le Centre de recherche Paul Pascal (CNRS/Université de Bordeaux), ils ont aussi exploré la biodiversité pour identifier des enzymes thermostables qui résistent à des températures entre 25° et 80°.
Faire évoluer ces bioprocédés du laboratoire vers un développement industriel supposait cependant de lever deux verrous majeurs : en 2014, leur premier prototype était notamment limité par les faibles puissances générées et par la stabilité des enzymes. Un changement d'échelle était donc nécessaire, tout en maintenant l'activité des enzymes et en les protégeant d'inhibiteurs éventuels. Troisième enjeu majeur, la diminution des coûts, et donc entre autres, minimiser les quantités d'enzymes mises en jeu. Autant de points qui nécessitent un travail fondamental et pluridisciplinaire de compréhension des facteurs limitant la bioélectrocatalyse.
En incorporant progressivement les deux enzymes thermostables dans une architecture carbonée, les chercheurs ont apporté une solution à ces trois problématiques. La porosité adaptée d'un feutre de carbone fait office de structure hôte pour les enzymes, mais sert aussi de protection contre des espèces chimiques générées lors de la réduction de l'oxygène et qui altèrent l'activité des enzymes. La pile peut ainsi fonctionner sans perte de performance pendant plusieurs jours.
Grâce à cette architecture contrôlée et aux propriétés intrinsèques des enzymes, les chercheurs sont parvenus pour la première fois à quantifier la proportion d'enzymes participant effectivement au courant, mettant en évidence que les courants délivrés par le biocatalyseur sont très proches des objectifs attendus pour le platine. Ils ont de plus établi un modèle numérique permettant de déterminer la géométrie optimale de la pile. Ces biopiles apparaissent ainsi comme une alternative aux piles à combustibles classiques : la biomasse peut être utilisée à la fois pour fournir le combustible (l'hydrogène) mais également le catalyseur (les enzymes), par nature renouvelable.
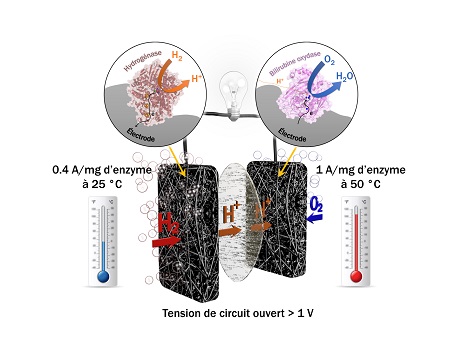
Biopile à combustible H2/O2 basée sur une hydrogénase thermostable résistante à l'oxygène et au monoxyde de carbone à l'anode et une bilirubine oxydase thermostable à la cathode fournissant des courants de l'ordre de l'ampère par milligramme d'enzymes.
Pour aller plus loin : Le bel avenir des biopiles, CNRS Le Journal, 25 juillet 2014.
Impact of Substrate Diffusion and Enzyme Distribution in 3D-Porous Electrodes: a combined electrochemical and modelling study of a thermostable H2/O2 Enzymatic Fuel Cell, Ievgen Mazurenko, Karen Monsalve, Pascale Infossi, Marie-Thérèse Giudici-Orticoni, Frédéric Topin, Nicolas Mano, Elisabeth Lojou, Energy & Environmental Science, 17 août 2017. DOI : 10.1039/C7EE01830D